- •Некоторые коды стран Международной ассоциации ean
- •Международный шифр добавки
- •Сравнительная характеристика различных сортов меда
- •Предельно допустимые концентрации нитратов в продуктах растениеводства
- •Шкала потребности растений в азотных удобрениях
- •Интенсивность запаха воды (в баллах)
- •Показатели качества воды
- •1. Какие балластные компоненты пищи Вам известны? Какую роль играют балластные компоненты в питании человека?
- •2. Кратко охарактеризуйте действие на человеческий организм так называемых социальных токсикантов.
- •Требования госТа, предъявляемые к губным помадам
- •Качество черного байхового чая по органолептическим показателям
- •Качество зеленого кирпичного чая по физико-химическим показателям
- •Тест на обеспеченность кальцием
- •Тест на обеспеченность калием
- •Тест на обеспеченность железом
- •Тест на обеспеченность витамином а
- •Тест на обеспеченность витамином д
- •Тест на обеспеченность витаминами группы в
- •Тест на обеспеченность витамином е
- •Тест на обеспеченность витамином с
Показатели качества воды
Характеристики воды |
Вода |
||
холодная |
горячая |
бутилированная |
|
Запах |
|
|
|
Вкус |
|
|
|
Прозрачность |
|
|
|
рН |
|
|
|
Жесткость общая |
|
|
|
Содержание активного хлора |
|
|
|
Контрольные вопросы и задачи.
1. Для стерилизации сточных вод, содержащих различные бактерии, перед их сбросом в водоемы используются два химических метода: хлорирование и озонирование. Какой из реагентов – хлор или озон – оказывает более сильное воздействие на бактерии? (φoCl2/2Cl- = + 1.36 В; φoO3/O2 = + 2.03 В).
2. Определите суточный расход (г) хлора на хлорирование воды в городе с миллионом жителей, если принять, что расход воды на человека 350 л, а норма расхода хлора 2⋅10–4 г/л.
3. Какова минимальная суммарная масса (кг) каждого из перечисленных металлов, которые могут ежедневно проходить через городскую сеть водоснабжения мощностью 1⋅107 л в день, если концентрация этих металлов не должна превышать: цинка - 5 мг/л, кадмия - 0,01 мг/л, марганца - 0,05 мг/л, меди - 1 мг/л.
4. В пресной воде, предназначенной для водоснабжения, концентрация ионов кальция составляет 2,2⋅10–3 моль/л, а концентрация бикарбонат-иона равна 1,3⋅10–3 моль/л. Какие количества (кг) гидроксида кальция и карбоната натрия необходимы для снижения уровня содержания ионов кальция в четыре раза, если требуется подготовить 1⋅107 л воды.
5. Фтор поступает в организм человека с продуктами питания и водой. В некоторых районах содержание фтористых солей в питьевой воде в пересчете на фторид натрия составляет 2 мг/л. Считая, что человек в среднем потребляет в сутки 2 л воды, вычислите, сколько (мг) фтора вводится ежедневно в организм человека? Напишите уравнение диссоциации фторида натрия и укажите, в каком виде фтор поступает в организм. К чему может привести избыток фтора в организме?
6. Для определения содержания сульфат-ионов в воде минерального источника к 150 мл ее прибавили 25 мл 0,1115 М раствора хлорида бария. Не фильтруя осадок сульфата бария, добавили к смеси аммонийный буфер, содержащий комплексонат магния, и оттитровали 14 мл 0,01242 М ЭДТА. Вычислите концентрацию (мг/л) сульфат-ионов в воде.
7. Определите концентрацию (моль/л) хлора в воде, если для его удаления из воды объемом 1 м3 потребовался раствор тиосульфата натрия объемом 500 мл (концентрация 0,1 моль/л).
8. Для определения железа в воде колориметрическим методом в две мерные колбы емкостью 25 мл ввели в первую 6 мл и во вторую 9 мл стандартного раствора железа (ТFe = 0,0100 г/мл), в третью колбу - 20 мл испытуемого раствора. После добавления соответствующих реактивов были определены оптические плотности растворов на фотоэлектроколориметре: А1= 0,33; А2= 0,63; Ах= 0,51. Вычислите содержание (мг/л) железа в анализируемой воде.
9. На титрование 200 мл воды из Невы было затрачено 2,25 мл 0,1 н раствора KMnO4 (К= 0,8466). Вычислите окисляемость воды и сделайте вывод о загрязнении ее восстановителями, если норма окисляемости по кислороду 7,6 мг/л.
10. Во сколько раз за сутки растение элодея канадская массой 200 кг может снизить концентрацию гидрокарбоната кальция в водоеме объемом 1000 м3, если 100 кг этого растения за 10 часов вызывают осаждение 2 кг углекислого кальция? Начальная равновесная концентрация [CO2] = 30 мг/л.
Лабораторная работа № 16. Химические опыты с шоколадом
Цель работы. Моделирование методики контроля и анализа качества кондитерского шоколада.
Оборудование и материалы:
Шоколад.
0.5 н. раствор перманганата калия.
2 М раствор гидроксида натрия.
1 М раствор серной кислоты
Молибденовый реактив (7.5 г молибдата аммония (NН4)6Mo7O24 в 100 мл 32 %-ного раствора азотной кислоты).
32 %-ный раствор азотной кислоты.
Азотная кислота концентрированная.
25 %-ный раствор аммиака.
10 %-ный раствор сульфата меди(II).
96 %-ный этиловый спирт.
Оксид магния.
Фильтровальная бумага, фольга, вата, пробирки, пипетки, фарфоровая чашка, стекло, электрическая плитка.
Методика выполнения работы.
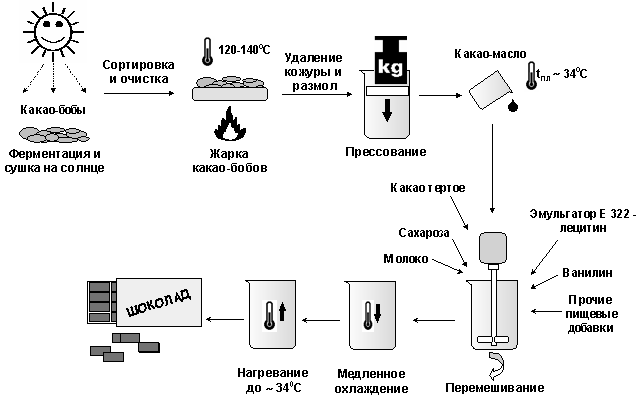
Шоколад – одно из самых распространенных кондитерских изделий. Он содержит жиры, белки, углеводы, дубильные вещества, алкалоиды кофеин и теобромин. Готовят его на основе какао-продукта (рис. 16.1).
|
Рис. 16.1. Схема производства шоколада
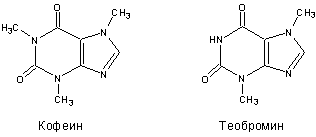
Плоды какао содержат в среднем (масс. %): масло, называемое маслом какао или теоброминовым маслом – 35-50, теобромин – 1-4, кофеин – 0.2-0.5, танины и прочие вещества. Масло какао состоит из глицеридов олеиновой (примерно 35 %), стеариновой (35 %), пальмитиновой (26 %) и линолевой (3 %) кислот. Содержание в шоколаде алкалоидов кофеина и теобромина может достигать 1.0-1.5 % (теобромина – до 0.4 %). Они представляют собой природные стимуляторы, и ими объясняется тонизирующие действие шоколада на организм человека.
Шоколад чувствителен к колебаниям температуры, поэтому рекомендуется хранить его при температуре около 18 оС. При нагревании шоколада происходит жировое поседение – он покрывается серым налетом. Это содержащиеся в шоколаде жиры проступают на его поверхности. При температуре ниже 18 оС происходит сахарное поседение шоколада, вызванное конденсацией паров воды и частичным растворением сахарозы, содержащейся в шоколаде. После испарения влаги кристаллики сахарозы образуют белый налет на поверхности шоколада.
Шоколад бывает горьким, полугорьким (состоит из какао продуктов, сахара и ароматизаторов) и с добавками (молочные продукты, орехи, изюм и другие), например, молочный.
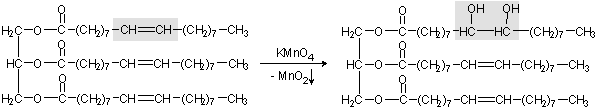
Обнаружение в шоколаде непредельных жиров. Кусочек шоколада обернуть фильтровальной бумагой и надавить на него, чтобы на бумаге появились жировые пятна. Поместить на пятно каплю 0.5 н. раствора перманганата калия. При этом образуется бурый оксид марганца(IV) вследствие протекания окислительно-восстановительной реакции:
Обнаружение в шоколаде углеводов. Насыпьте в пробирку примерно 1 см по высоте тертого шоколада и прилейте 2 мл дистиллированной воды. Встряхните содержимое пробирки несколько раз и отфильтруйте. К фильтрату добавьте 1 мл 2 М раствора гидроксида натрия и 2-3 капли 10 %-ного раствора сульфата меди(II). Встряхните пробирку. Появляется ярко-синее окрашивание, которое дает многоатомный спирт сахароза.
Фосфоросодержащие компоненты шоколада. Измельчите 1 кубик шоколада и поместите порошок в небольшую колбу, затем прилейте 15 мл 96 %-ного раствора этилового спирта. Взболтайте смесь и нагрейте ее в течении 15-20 мин, не доводя до кипения. Смесь охлаждают и фильтруют. Переносят полученный фильтрат в другую колбу, добавляют 5 мл 1 М раствора серной кислоты и кипятят в течение 15 мин. Охлаждают смесь и фильтруют. Получают розово-коричневый раствор. После охлаждения наливают 1 мл полученного раствора и приливают 1 мл молибденового реактива. Нагревают смесь на водяной бане. Образуется желтый мелкокристаллический осадок.
При кислотном гидролизе фосфопротеидов молока (если шоколад молочный) и фосфатида лецитина (эмульгатора шоколада) образуется фосфат-ионы, которые реагируют с молибдатом аммония:
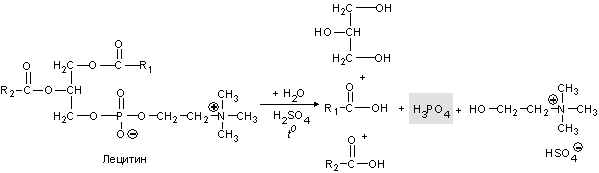
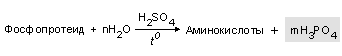
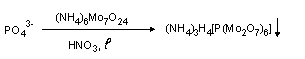
Моделирование сахарного поседения шоколада. Опрыскивают несколько кубиков шоколада водой, заворачивают в фольгу и помещают на 1-2 недели в холодильник (не в морозильное отделение). В результате на поверхности шоколада появится налет. Это выступили кристаллики сахарозы. Смывают налет 3-5 мл дистиллированной воды, добавляют к смыву 1 мл раствора щелочи и 1-2 капли раствора сульфата меди(II). Появляется характерное ярко-синее окрашивание.
Ксантопротеиновая реакция. Насыпают в пробирку 1 см тертого шоколада и приливают 2-3 мл дистиллированной воды. Встряхивают содержимое пробирки несколько раз и фильтруют. Приливают к 1 мл фильтрата 0.5 мл концентрированной азотной кислоты (осторожно!). Нагревают полученную смесь. Наблюдают желтое окрашивание, переходящее в оранжево-желтое при добавлении 25 %-ного раствора аммиака. Такую реакцию дают остатки ароматических аминокислот, входящие в состав белков шоколада.
Обнаружение
кофеина и выделение масло какао.
Помещают в фарфоровую чашку смесь
черного шоколада и оксида магния в
соотношении 2,5:1 (по массе). Накрывают
стеклянной пластиной и ставят на
электроплитку, используя огнезащитную
п рокладку.
Нагревают содержимое, не допуская
обугливания. Происходит возгонка кофеина
(tвозг
< tпл;
tпл
= 235-237 оС).
Он кристаллизуется по краям стеклянной
пластины, а в центре ее конденсируется
желто-коричневое масло.
рокладку.
Нагревают содержимое, не допуская
обугливания. Происходит возгонка кофеина
(tвозг
< tпл;
tпл
= 235-237 оС).
Он кристаллизуется по краям стеклянной
пластины, а в центре ее конденсируется
желто-коричневое масло.
Снимают масло со стекла ватой, помещают в другую пробирку и приливают 2 мл хлороформа. Получают желтый раствор. Аккуратно, чтобы не попала вата, переливают его в другую колбу и добавляют 2-3 капли 0.5 н. раствора перманганата калия. Происходит восстановление KMnO4 содержащимися в масле непредельными жирами до бурого оксида марганца(IV), выпадающего в осадок.
Оформление результатов работы. Записать методику работы, наблюдаемые явления.
Контрольные вопросы и задачи.