
- •Некоторые коды стран Международной ассоциации ean
- •Международный шифр добавки
- •Сравнительная характеристика различных сортов меда
- •Предельно допустимые концентрации нитратов в продуктах растениеводства
- •Шкала потребности растений в азотных удобрениях
- •Интенсивность запаха воды (в баллах)
- •Показатели качества воды
- •1. Какие балластные компоненты пищи Вам известны? Какую роль играют балластные компоненты в питании человека?
- •2. Кратко охарактеризуйте действие на человеческий организм так называемых социальных токсикантов.
- •Требования госТа, предъявляемые к губным помадам
- •Качество черного байхового чая по органолептическим показателям
- •Качество зеленого кирпичного чая по физико-химическим показателям
- •Тест на обеспеченность кальцием
- •Тест на обеспеченность калием
- •Тест на обеспеченность железом
- •Тест на обеспеченность витамином а
- •Тест на обеспеченность витамином д
- •Тест на обеспеченность витаминами группы в
- •Тест на обеспеченность витамином е
- •Тест на обеспеченность витамином с
Предельно допустимые концентрации нитратов в продуктах растениеводства
Продукт |
Содержание, мг/кг |
Продукт |
Содержание, мг/кг |
Kартофель |
250 |
Томаты |
150/300 |
Kапуста белокочанная ранняя |
900 |
Огурцы |
150/400 |
Kапуста белокочанная поздняя |
500 |
Свекла столовая |
1400 |
Морковь ранняя |
400 |
Лук репчатый |
80 |
Морковь поздняя |
250 |
Листовые овощи (салат, петрушка, укроп) |
2000 |
Перец сладкий |
200 |
Арбузы |
60 |
Kабачки |
400 |
Виноград |
60 |
Дыни |
90 |
Яблоки, груши |
60 |
На предметное стекло положить несколько срезов той или иной части растения. Затем на каждый срез нанести по одной капли 1 %-го раствора дифениламина и следить за появлением синей окраски. Интенсивность этой окраски сравнить с данными табл. 12.2, показывающей степень нуждаемости растений в азотных удобрениях. Содержание нитратов снижается с возрастом растений, а к цветению они почти исчезают.
Таблица 12.2
Шкала потребности растений в азотных удобрениях
Визуальные признаки окраски среза |
Содержание нитратов |
Бледно-голубоватая, очень быстро наступает обугливание |
низкое |
Синяя, постепенно исчезающая |
среднее |
Темно-синяя или темно-фиолетовая, быстро наступающая, устойчивая |
высокое |
Бледно-голубая окраска среза от дифениламина свидетельствует об острой нуждаемости растения в нитрат-ионах. Синяя окраска говорит о недостатке азота в растении, а темно-фиолетовая – о том, что растение обеспечено азотом.
Определение нитритов. В результате участия ферментов и углеводов в растениях происходит восстановление нитратов до аммиака через нитриты:
NO3- → NO2- → NO → NH2OH → NH3
Образующийся аммиак взаимодействует с органическими кислотами, в результате получаются аминокислоты:
NH3 + органическая кислота → аминокислота.
Для проведения качественной пробы на присутствие нитритов в растениях на поверхность свежего среза наносят несколько кристалликов дифениламина и смачивают их двумя каплями концентрированной серной кислоты. Интенсивное синее окрашивание среза указывает на наличие большого количества нитритов, розовое – на небольшое их содержание, отсутствие окрашивания – на отсутствие нитритов или на очень незначительное их содержание.
Для определения нитритов и нитратов можно воспользоваться аптечными препаратами антипирином (пирамидон) и стрептоцидом, которые выполняют функцию восстановителя, при этом появляется характерное окрашивание.
Оформление результатов работы. Записать ход работы, определить наличие нитратов и нитритов в продукции, сделать выводы о пригодности продуктов в пищу.
Контрольные вопросы и задачи.
1. Каковы основные источники поступления нитратов, нитритов и нитрозаминов в продукты питания и пищевое сырье?
2. Охарактеризуйте действие соединений азота на человеческий организм, укажите потенциальную опасность этих соединений.
3. Какие методы определения нитратов, нитритов и нитрозаминов в пищевых продуктах рекомендуется использовать в практике сертификационных испытаний?
4. Как относятся к нагреванию следующие соли аммония: хлорид, сульфат, дихромат, нитрат, нитрит, карбонат? Составьте соответствующие уравнения реакций.
5. Смесь карбоната натрия, оксалата натрия и хлорида натрия массой 4,0066 г растворили в воде. Половину полученного раствора, подкисленного азотной кислотой, обработали избытком раствора нитрата серебра. При этом выпал белый осадок массой 0,9615 г. Вторую половину полученного раствора обработали избытком раствора нитрата серебра в нейтральной среде. Выпавший белый осадок обработали цинком в присутствии избытка соляной кислоты и получили осадок серого цвета массой 3,6147 г, нерастворимый в соляной кислоте. Определите количественный состав (масс. %) смеси солей.
6. При прокаливании нитрата аммония массой 8 г выделился газ. Такое же количество газа получается при обработке 16 г неизвестного металла 60%-ным раствором азотной кислоты (ρ = 1,375 г/мл). Определите формулу неизвестного металла и объём (мл) израсходованного раствора азотной кислоты, если одним из продуктов реакции является нитрат металла(II). Какое количество (г) соли можно получить, если исходную навеску металла обработать водой и через образовавшийся раствор пропустить избыток оксида углерода(IV)?
7. Кроссворд. По вертикали: 2. Важный фактор, от которого зависит накопление в овощах нитратов. 3. Один из способов снижения содержания нитратов в овощах. 4. Элемент полезный для укрепления сердечной мышцы, содержится в кураге и изюме. 5. Канцерогенное вещество, в которое превращается азот в организме человека, при избыточном количестве. По горизонтали: 1. Реактив с помощью которого определяют нитрат-ион. 2. Сельскохозяйственное растение почти не накапливающее нитратов. 4. Источник нитратов – продукт питания. 6. Название нитратных удобрений. 7. Одно из последующих влияний избыточного количества нитратов на человека. 8. Этот овощ очень полезно употреблять зимой, в период массового заболевания гриппом.
2
6
3
5
1
4
8
7
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
8. Химкомбинат по производству азотных удобрений из-за поломки главного конвейера допустил сброс нитрата аммония в близлежащее озеро. Выживут ли ушастые окуни, живущие в озере, если известно, что сбросили 30 000 кг нитрата аммония, а объем озера – 5 000 л. Токсическая концентрация нитрата аммония для ушастых окуней составляет 800 мг/л.
9. Содержащиеся в растениях нитраты могут восстанавливаться в нитриты и реагировать в желудке с входящими в состав пищевых продуктов вторичными аминами с образованием сильных канцерогенов – нитрозаминов. Определите, могут ли in vivo нитрат-анионы восстанавливаться аскорбиновой кислотой с образованием нитрит-ионов.
10. Предельно допустимая концентрация (масс.%) ионов меди в воде составляет 0,1 мг/л. Для очистки промышленных стоков от ионов Cu2+ осаждают гидроксид меди(II) добавлением щелочи. Какое значение рН при 25°С необходимо поддерживать в растворе для снижения содержания ионов меди до предельно допустимого?
Лабораторная работа № 13. Анализ растительных масел и молочной продукции.
Цель работы. Овладеть методикой исследования пищевых продуктов. Моделирование методики анализа молока.
Оборудование и материалы:
Кефир, растительные масла, молоко свежее и кипяченное.
Раствор гидроксида натрия.
Раствор йода в йодиде калия.
Формальдегид.
Спиртовой раствор метиленового синего.
Бромная вода.
Пробирки.
Дистиллированная вода.
3 %-ный раствор уксусной кислоты.
1 %-ный раствор гидроксида натрия.
Гидроксид меди(II).
Раствор сульфата меди(II).
Раствор ацетата свинца.
4 %-ный раствор молибдата аммония в азотной кислоте.
Пробирки, колбы, горелка.
Методика выполнения работы.
Обнаружение растительных масел. В пробирки наливают по 1 мл различных растительных масел (подсолнечное, конопляное, оливковое и др.) или одного и того же масла с разным сроком хранения. Каждую пробирку нагревают и добавляют, перемешивая, по каплям бромную воду, до тех пор, пока она не перестанет обесцвечиваться. Число капель необходимо зафиксировать и сравнить результаты друг с другом.
Обнаружение этанола. Для обнаружения этанола кефир и молочную сыворотку фильтруют. В пробирки наливают по 5 капель фильтрата кефира и молочной сыворотки, добавляют по 5 капель 10 %-ного раствора гидроксида натрия, а также несколько капель раствора йода в йодиде калия. Жидкость мутнеет. Объясните наблюдаемое явление.
Обнаружение ферментов.
Обнаружение оксидоредуктазы. В первую пробирку добавляют 5 капель свежего молока и 2-3 капли формальдегида, во вторую – 2-3 капли формальдегида и 5 капель кипяченого молока. Затем в обе пробирки добавляют по 2-3 капли метиленовой сини. Пробирки нагревают на водяной бане при температуре 70 ºС до обесцвечивания раствора. Записывают время прошедшее до обесцвечивания.
Молоко представляет собой эмульсию молочных (жировых) шариков в молочной плазме. В состав молока входит вода, жиры, белки (казеиноген, молочный альбумин и молочный глобулин), углеводы (лактоза, глюкоза), ферменты (амилаза, липаза, каталаза), витамины (А, С, D, группы В), минеральные вещества (соли калия, натрия, кальция, магния).
Осаждение казеиногена. В небольшую колбу наливают 2.5 мл молока и 5 мл дистиллированной воды, перемешивают содержимое колбы и добавляют по каплям 1 мл 3 %-ного раствора уксусной кислоты. Затем опять хорошо перемешивают и оставляют стоять 5-10 мин. Выпавший осадок (казеиноген и жиры) отфильтровывают, а фильтрат разливают по пробиркам и используют в следующих опытах.
После промывания осадок растворяют на фильтре 1 %-ным раствором гидроксида натрия. С полученной жидкостью проводят биуретовую реакцию.
Обнаружение глюкозы. В пробирку с 3-4 каплями раствора сульфата меди(II) приливают 1 мл раствора гидроксида натрия. К полученному осадку приливают фильтрат и взбалтывают смесь. Затем содержимое пробирки нагревают. Наблюдения записывают.
Обнаружение солей фосфорной кислоты. В пробирку с фильтратом добавляют 5-6 капель 4 %-ного раствора молибдата аммония в азотной кислоте и нагревают до кипения. Наблюдают медленное образование желтого кристаллического осадка. Укажите, какое вещество образовалось?
Осаждение белков. В две пробирки наливают по 1 мл молока. В первую пробирку добавляют 2-3 капли раствора сульфата меди(II), во вторую – 2-3 капли раствора ацетата свинца(II). Наблюдают осаждение белков молока.
Оформление результатов работы. Записать методику работы, происходящие явления, сделать вывод о качестве исследованных пищевых продуктов.
Контрольные вопросы и задачи.
1. Чем отличаются по химическому строению жидкие жиры от твердых? Приведите примеры.
2. Почему жиры широко используют для приготовления пищи? Почему при длительной варке мясной бульон становится мутным и салистым? Почему жиры портятся при хранении?
3. Почему прогорание не грозит маргарину?
4. Вычислите, массу (г) масла жирностью 82,5 масс. %, которое можно получить из 750 л молока жирностью 3,2 %, если выход масла 85 % от теоретического.
5. Один стакан цельного молока содержит 288 мг кальция. Сколько (мл) нужно выпивать в день молока для снабжения вашего организма достаточным количеством этого элемента? (Суточная потребность человеческого организма 800 мг Са.)
6. При сгорании 1 моль жира образуется 57 моль оксида углерода(IV) и 54 моль воды. Напишите две возможные формулы жира, образованного кислотами с четным числом углеродных атомов.
7. Образец жира может вступить в реакцию с 0,4 моль водорода. Продукт гидрирования вступает в реакцию гидролиза с 0,6 моль гидроксида натрия. При этом образуется соль только одной кислоты, массой равной 183,6 г. Вычислите относительную молекулярную массу жира и приведите одну из возможных его формул.
8. Образец жира вступает в реакцию кислотного гидролиза. Масса продуктов гидролиза на 2,7 г больше массы исходного жира. В результате гидролиза образовалась только одна кислота массой 38,4 г. Вычислите относительную молекулярную масcу жира и приведите одну из возможных его формул.
9. На химкомбинате в резервуар с питьевой водой высыпалось из плохо упакованного пакета 3,5 кг гидроксида бария, полностью перешедшего в раствор. Специалисты СЭС предложили очистить питьевую воду с помощью серной кислоты. Вычислите массу (г) 60 %-ного раствора серной кислоты, необходимого для нейтрализации.
10. С целью обнаружения фенола в промышленных сточных водах используют его способность образовывать окрашенные комплексные соединения с некоторыми неорганическими веществами. Назовите эти вещества. Приведите примеры производств, сбрасывающих в воду отходы, содержащие фенол. Как его можно обезвредить?
Лабораторная работа № 14. Исследование мороженого
Цель работы. Моделирование методики анализа мороженного.
Оборудование и материалы:
Мороженое.
Дистиллированная вода.
2 М раствор гидроксида натрия.
10 %-ный раствор сульфата меди(II).
Концентрированная азотная кислота.
25 %-ный раствор аммиака.
Насыщенный раствор питьевой соды.
5-10 %-ный раствор гидроксида натрия.
Спиртовой раствор йода.
Пробирки, электрическая плитка.
Методика выполнения работы.
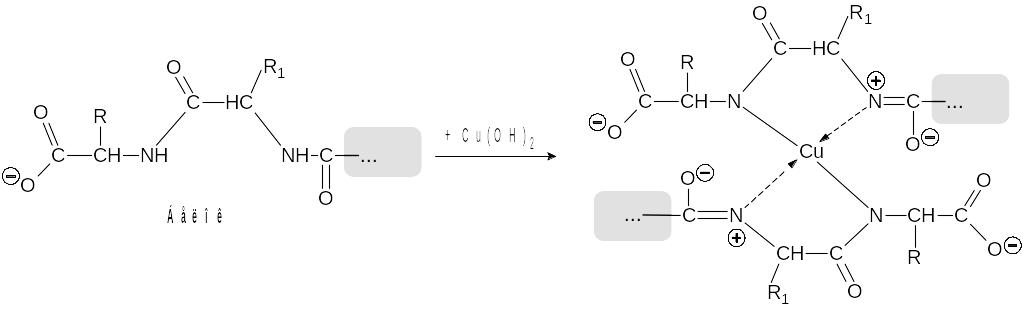
Обнаружение белков в мороженом. В пробирку наливают 1 мл растаявшего мороженого и 5-7 мл дистиллированной воды, закрывают ее пробкой и встряхивают. К 1 мл полученной смеси приливают 1 мл 2 М раствора гидроксида натрия и несколько капель 10 %-ного раствора сульфата меди(II). Содержимое пробирки встряхивают. Происходит биуретовая реакция, при этом появляется ярко-фиолетовое окрашивание, связанное с взаимодействием пептидных связей белковых молекул со свежеосажденным гидроксидом меди(II):
Обнаружение остатков ароматических α-аминокислот. В пробирку наливают 1 мл раствора, приготовленного в предыдущем опыте, и приливают к нему 3-5 капель раствора концентрированной азотной кислоты. Смесь нагревают. Появляется желтое окрашивание. Объясните его причину.
Поле охлаждения к смеси добавляют 3-5 капель 25 %-ного раствора аммиака, происходит изменение цвета с желтого до оранжевого.
Обнаружение крахмала в вафельном стаканчике из-под мороженного. На вафельный стаканчик капают 1-2 капли спиртового раствора йода. Появляется темно-фиолетовое окрашивание, качественная реакция на крахмал.
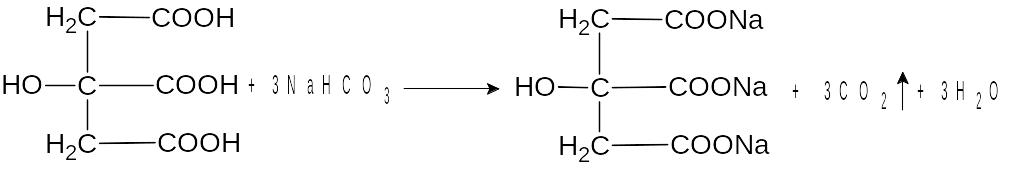
Обнаружение лимонной кислоты (пищевой добавки Е330) в плодово-ягодном мороженом. В пробирку налейте 1 мл растаявшего мороженого и добавьте 1 мл насыщенного раствора пищевой соды. Наблюдается появление пузырьков углекислого газа из-за протекания следующей реакции:
Обнаружение углеводов в молочном мороженом. Мороженое на молочной основе содержит дисахариды лактозу и сахарозу. В пробирку налейте 1 мл такого мороженого и добавьте 5–7 мл дистиллированной воды. Пробирку закройте пробкой и встряхните несколько раз. Профильтруйте полученную смесь и к фильтрату добавьте 1 мл 5-10 %-ного раствора гидроксида натрия и 2–3 капли 10 %-ного раствора сульфата меди(II). Содержимое пробирки осторожно встряхните. Образуется ярко-синий раствор комплексного соединения сахарозы и лактозы с медью(II). Это качественная реакция на многоатомные спирты:
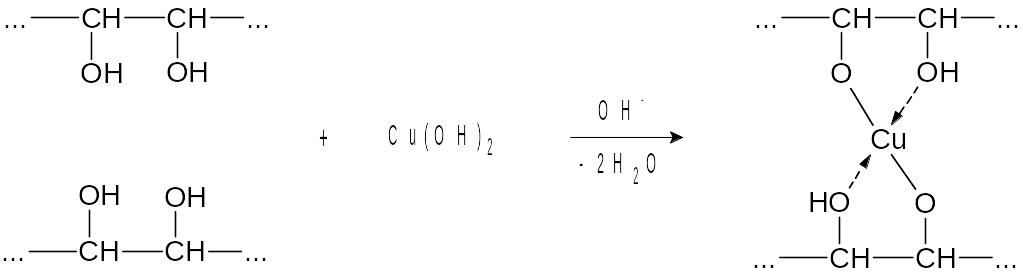
Полученный раствор нагрейте на спиртовке. Лактоза, находясь в нециклической (альдегидной) форме реагирует с гидроксидом меди(II). При этом образуются различные продукты окисления и деструкции лактозы. Гидроксид меди(II) восстанавливается до оранжевого гидроксида меди(I), который потом разлагается до оксида меди(I) красного цвета. В ходе реакции может выделиться и медь. Упрощенно процесс можно представить следующими уравнением:
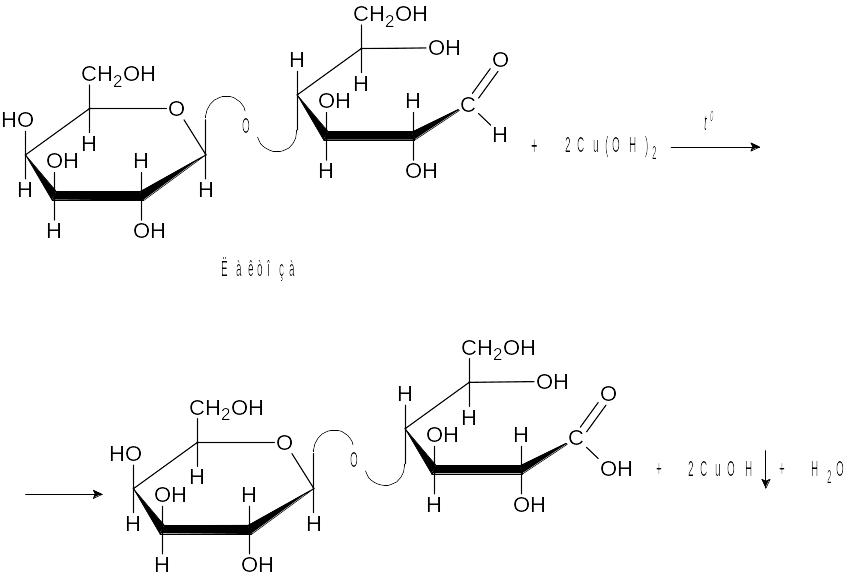
2CuOH
![]() Сu2O
+ H2O.
Сu2O
+ H2O.
Обнаружение сахарозы в плодово-ягодном мороженом. В плодово-ягодном мороженом содержится сахароза. В пробирку наливают 1 мл растаявшего мороженого и 1 мл 5-10 %-ного раствора гидроксида натрия. Затем приливают 2–3 капли 10 %-ного раствора сульфата меди(II). Наблюдают ярко-синее окрашивание (качественная реакция на многоатомные спирты).
Оформление результатов работы. Записать методику работы, наблюдаемые явления, сделать выводы о качестве мороженного.
Контрольные вопросы и задачи.
1. Что такое аминокислоты? На какие группы и по каким признакам делятся аминокислоты? Приведите примеры аминокислот каждого вида.
2. Какие виды изомерии характерны для аминокислот? Приведите примеры изомерии каждого вида.
3. Напишите структурные формулы следующих аминокислот: глицин, аланин, лизин, серин, цистеин, гистидин.
4. Почему аминокислоты являются органическими амфотерными соединениями? Напишите схему образования внутренней соли аланина.
5. Запишите уравнения и укажите условия протекания реакций, при помощи которых, используя только неорганические реагенты и катализаторы можно получить этиловый эфир глицина.
6. Определите строение вещества, имеющего состав С6H12O3S2N2, если известно, что из него можно получить соединение состава C3H9O6S2N.
7. Сколько оптических изомеров имеет валин и триптофан? Напишите для них проекционные формулы Фишера. Обладает ли оптической активностью глицин? Свой ответ поясните.
8. Производным какой аминокислоты можно считать противоопухолевый препарат сарколизин (см. формулу)? Сколько стереоизомеров будет у сарколизина? Напишите для них проекционные формулы Фишера.

9. Какова роль хроматографии при работе аминокислотного анализатора?
10. Для идентификации аминокислот при хроматографическом анализе используют орто-фталевый альдегид. Он реагирует с аминокислотами по схеме:

Составьте уравнение реакции аланина с этим реагентом.
Лабораторная работа № 15. Определение качества водопроводной и бутилированной воды
Цель работы. Оценить пригодность воды для питья, используя методы органолептического и химического анализа.
Оборудование и материалы:
Водопроводная и бутилированная вода.
Аммиачный буферный раствор (10 г кристаллического хлорида аммония растворить в стакане с дистиллированной водой, перелить содержимое стакана в колбу на 500 мл, добавить 50 мл 20 %-ного раствора аммиака, довести объем до метки 500 мл).
Индикатор – кислотный хром темно-синий.
0.05 н. раствор трилона Б (приготовление комплексона: 1.86 г трилона Б поместить в мерную колбу на 100 мл и растворить в небольшом объеме дистиллированной воды, после растворения навески довести объем водой до метки, тщательно перемешивая).
Йодид калия.
Раствор крахмала (приготовление раствора крахмала: растереть 1 г крахмала с 25 мл холодной воды, вылить кашицу при перемешивании в 175 мл кипящей воды, раствор кипятить 2 мин и охладить).
Колбы на 250 и 500 мл, цилиндр, электрическая плитка.
Методика выполнения работы.
Определение органолептических характеристик. Наполните коническую колбу на 2/3 объема исследуемой водой. Понюхайте воду. Закройте колбу пробкой, сильно встряхните и снова понюхайте. Нагрейте колбу с водой в течение 2-3 мин, проверьте наличие запаха. Интенсивность запаха оцените в баллах (табл. 15.1).
Таблица 15.1
