
- •Федеральное агентство по образованИю государственное образовательное учреждение высшего профессионального образования «московский государственный текстильный университет имени а.Н.Косыгина»
- •Методические указания к лабораторным работам по дисциплине «Физическая химия»
- •Часть 1
- •Содержание
- •1.Методы определения строения молекул
- •Лабораторная работа №1. Определение рефракции и структурной формулы вещества
- •2.Термохимия
- •Лабораторная работа №3. Определение интегральной теплоты растворения соли (безводной и кристаллогидрата) и расчет теплоты гидратации
- •Описание калориметрической установки
- •Порядок работы на калориметре
- •Способы определения теплоемкости калориметрической системы
- •Порядок выполнения работы
- •3. Химическое равновесие
- •Лабораторная работа №4. Определение константы равновесия реакции взаимодействия салициловой кислоты с треххлористым железом в водном растворе
- •Методика проведения работы по определению равновесной концентрации железо-салицилового комплекса
- •Порядок проведения работы:
- •4. Фазовые равновесия в многокомпонентных жидких системах
- •Лабораторная работа №5. Изучение взаимной растворимости жидкостей и фазового равновесия в двухкомпонентной системе
- •Порядок выполнения работы
- •Порядок выполнения работы
4. Фазовые равновесия в многокомпонентных жидких системах
Гетерогенные жидкие системы
Гетерогенными фазовыми равновесиями называются равновесия, устанавливающиеся в процессах перехода веществ из одной фазы (простой или смешанной) в другие фазы (простые или смешанные).
Такие равновесия наблюдаются при кипении жидкости под постоянным давлением (жидкость пар), плавлении кристаллов (твердое жидкость), выделении жидкой фазы из раствора жидких компонентов при изменении температуры (жидкость жидкость) и т.п.
Гетерогенные фазовые равновесия устанавливаются в гетерогенных системах. Гетерогенной называется система, состоящая из одного или более компонентов, входящих в состав минимум двух фаз, отделенных друг от друга поверхностью раздела.
В учении о фазовых равновесиях компонентами называют химически однородные вещества, являющиеся независимыми составляющими системы. для систем, в которых происходят химические реакции, число компонентов равно числу составляющих веществ минус число реакций между ними. Для систем, в которых не происходит химической реакции, число компонентов равно числу составляющих веществ. Фазой называется гомогенная часть гетерогенной системы, обладающая одинаковыми физико-химическим свойствами и отделенная от остальных частей системы поверхностью раздела. В пределах одной фазы термодинамические параметры могут изменяться монотонно, при переходе через межфазную границу происходит скачкообразное изменение параметров системы.
В зависимости от своей природы жидкости смешиваются друг с другом в разных соотношениях – от практической нерастворимости в любых условиях до неограниченной взаимной растворимости. Вещества, состоящие из молекул одинаковой или близкой полярности, смешиваются неограниченно, т.е. образуют гомогенные системы, а из молекул различной полярности вообще не смешиваются, т.е. образуют гетерогенные системы. Характерной особенностью многокомпонентных жидких систем с ограниченной растворимостью является изменение взаимной растворимости с изменением температуры. При этом часто ограниченная растворимость переходит в неограниченную. Этот переход у одних систем наблюдается при повышении температуры, а у других – при понижении.
Основным методом исследования фазовых равновесий является метод построения фазовых диаграмм. Фазовыми диаграммами называются графические зависимости состав – свойство, которые позволяют определить области сосуществования фаз.
Ограниченная растворимость наблюдается в том случае, когда переход молекул из одной фазы в другую связан с совершением работы, намного превышающей среднюю энергию движения молекул жидкости при данных условиях. Чем больше будет работа перехода, тем меньше будет доля молекул, способных совершать этот переход, и тем меньше будет растворимость одной жидкости в другой.
Если жидкости не взаимодействуют друг с другом, повышение температуры увеличивает долю молекул с повышенным запасом энергии движения, и такие молекулы способны осуществить работу перехода, а, следовательно, взаимная растворимость их будет увеличиваться. При некоторой температуре может наступить полное смешение жидкости, т.е. произойдет переход от гетерогенной системы к гомогенной.
Максимальная температура, при которой ограниченно-смешивающиеся жидкости неограниченно взаимно растворяются, называется верхней критической температурой растворения (ВКТР) или смешения (ВКТС).
В случае, когда ограниченно растворимые жидкости образуют друг с другом молекулярные соединения (ассоциаты), повышение температуры уменьшает их взаимную растворимость. Если при смешении ограниченно-смешивающихся жидкостей, взаимная растворимость наблюдается при минимальной температуре, то такая температура называется нижней критической температурой растворения (НКТР).
Существуют также системы, имеющие и верхнюю и нижнюю температуры растворимости.
Температура, при которой происходит фазовый переход (гетерогенная система – гомогенная система) зависит от состава смеси жидкостей с ограниченной растворимостью.
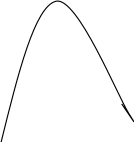
Диаграмма состояния или фазовая диаграмма двухкомпонентной системы жидкостей с ограниченной растворимостью в координатах состав – температура называется диаграммой растворимости. На рис. 4.1 приведена диаграмма растворимости системы вода – анилин. Кривая АВС, которая называется бинодаль, разделяет области существования гомогенной и гетерогенной систем. Область выше бинодали соответствует гомогенной системе, область под бинодалью – гетерогенной системе, одна из фаз, которой раствор воды в анилине, другая – раствор анилина в воде. Состав растворов, образующих сосуществующие фазы, определяется точками пересечения соответствующей изотермы с бинодалью (тт. а1 с1 и а2, с2). Точка В на бинодали – верхняя критическая температура растворения.
Для определения ВКТР и соответствующего этой температуре состава (критический состав) используют правило Алексеева. Для этого при различных произвольно выбранных температурах (например, Т1 и Т2) проводят изотермы, отрезки которых в пределах бинодали называются ноды (а1b1 и a2b2). Ноды делят пополам и через их середины проводят прямую. Один конец этой прямой пересекает ось составов, а другой бинодаль. Точка пересечения прямой с бинодалью (т.В) – ВКТР, точка пересечения с осью составов (т.Д) – критический состав.
 В
В
Т
 ,
оС
,
оС
150
Т 2
а2
b2
2
а2
b2
100
Т 1
a1
b1
1
a1
b1
50
А С
0 Д
Д
 0
50 100
0
50 100
масс. доля анилина, %
анилин, % |
вода, % |
ТоС |
23 |
96 |
43 |
24 |
92 |
70 |
25 |
85 |
100 |
27 |
80 |
120 |
29 |
77 |
140 |
30 |
70 |
150 |
50 |
50 |
168 |
Рис. 4.1. Диаграмма растворимости системы вода- анилин
