- •Федеральное агентство по образованИю государственное образовательное учреждение высшего профессионального образования «московский государственный текстильный университет имени а.Н.Косыгина»
- •Методические указания к лабораторным работам по дисциплине «Физическая химия»
- •Часть 1
- •Содержание
- •1.Методы определения строения молекул
- •Лабораторная работа №1. Определение рефракции и структурной формулы вещества
- •2.Термохимия
- •Лабораторная работа №3. Определение интегральной теплоты растворения соли (безводной и кристаллогидрата) и расчет теплоты гидратации
- •Описание калориметрической установки
- •Порядок работы на калориметре
- •Способы определения теплоемкости калориметрической системы
- •Порядок выполнения работы
- •3. Химическое равновесие
- •Лабораторная работа №4. Определение константы равновесия реакции взаимодействия салициловой кислоты с треххлористым железом в водном растворе
- •Методика проведения работы по определению равновесной концентрации железо-салицилового комплекса
- •Порядок проведения работы:
- •4. Фазовые равновесия в многокомпонентных жидких системах
- •Лабораторная работа №5. Изучение взаимной растворимости жидкостей и фазового равновесия в двухкомпонентной системе
- •Порядок выполнения работы
- •Порядок выполнения работы
3. Химическое равновесие
Математическим выражением законов термодинамики для равновесия химических процессов является закон действующих масс, который в простейшем случае можно сформулировать следующим образом:
отношение произведения равновесных концентраций (или парциальных давлений) продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам к аналогичному произведению для исходных веществ при данной температуре есть величина постоянная. Таким образом, для реакции вида:
а А
+ bB
cC
+ dD
А
+ bB
cC
+ dD
![]() (3.1)
(3.1)
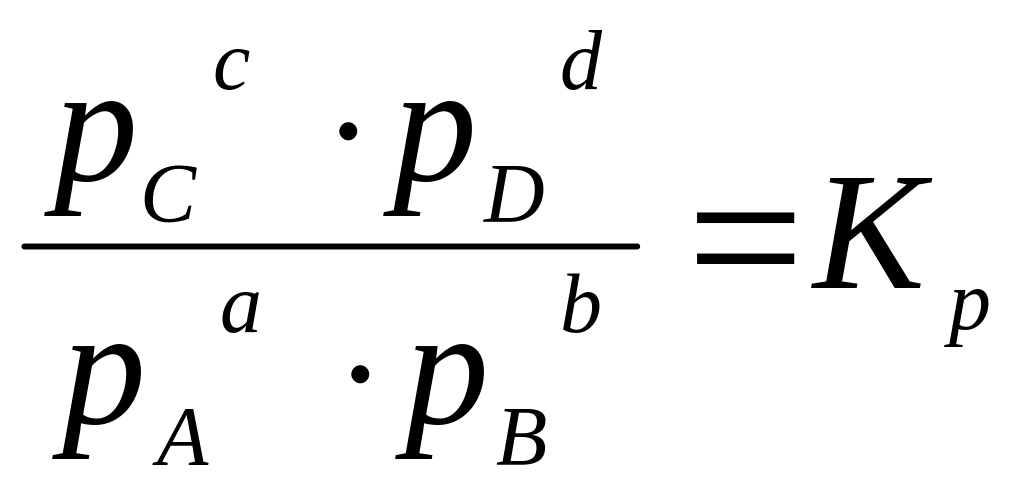 (3.2)
(3.2)
где Кс и Кр – константы равновесия этой реакции при определенной температуре.
Константы
равновесия химической реакции позволяет
знать направление и предел ее возможного
протекания. Если для реакционной смеси
с определенными значениями парциальных
давлений р’A,
р’B,
р’C
и р’D
составить выражение
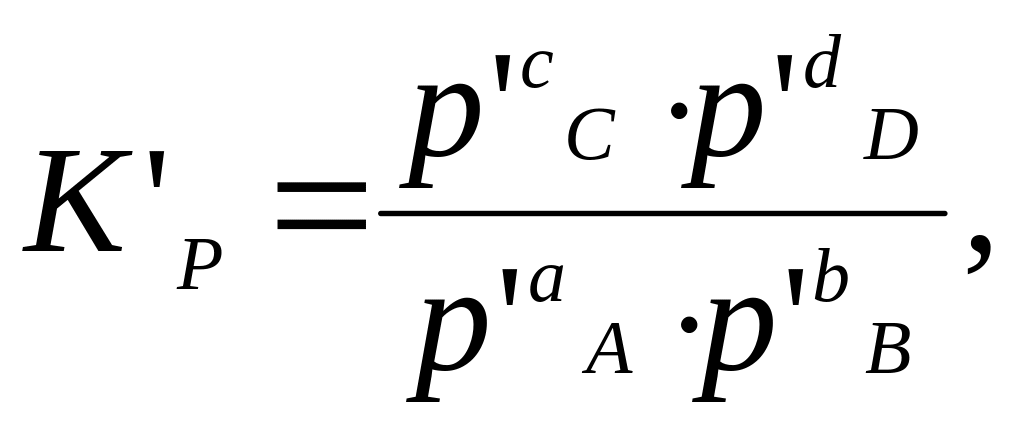 то связь между Кр
и G
(потенциалом Гиббса) можно описать
уравнением:
то связь между Кр
и G
(потенциалом Гиббса) можно описать
уравнением:
-G = RT ln(Kp – K’p), (3.3)
которое называется уравнением изотермы химической реакции (изотермы Вант-Гоффа при T=const и p=const).
С помощью уравнения изотермы (3.3) можно определить химическое сродство различных веществ, т.е. характеризовать их способность вступать во взаимодействие друг с другом. При этом определяется стандартное сродство (G0), относящееся к предполагаемому протеканию реакций в стандартных условиях
Р’A = P’B = P’C = P’D = 1
Тогда ln К’p = 0, и уравнение изотермы упрощается:
- Gо = RT ln Kp (3.4)
Из уравнений (3.3) и (3.4) получаем уравнение
G = -Gо + RT lnK’p (3.5)
для определения сродства в нестандартных условиях.
Справедливы аналогичные уравнения
-F0 = RT ln Kc (3.6)
F = -Fо + RT lnK’c (3.7)
где F и F0 – потенциал Гельмгольца и стантартное сродство (при T=const и V=const).
Следует отметить, что если реакция идет без изменения числа молей в газовой фазе, то Кр = Кс.
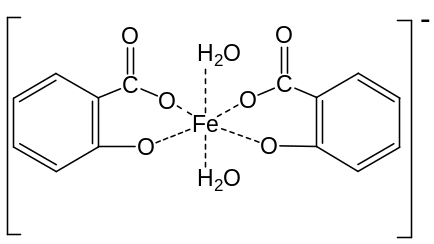
Лабораторная работа №4. Определение константы равновесия реакции взаимодействия салициловой кислоты с треххлористым железом в водном растворе
Цель работы: Определение константы равновесия химической реакции с использованием спектрофотометрического метода.
Состав продукта реакции салициловой кислоты с хлорным железом зависит от рН реакционной среды:
|
|
|
рН 2 – 3 фиолетовое окрашивание |
рН 3 – 8 фиолетово-красное окрашивание |
рН 8 – 12 желтое окрашивание |
При реакции салициловой кислоты с хлорным железом при рН=2,0-2,5 образуется комплексный катион фиолетового цвета:
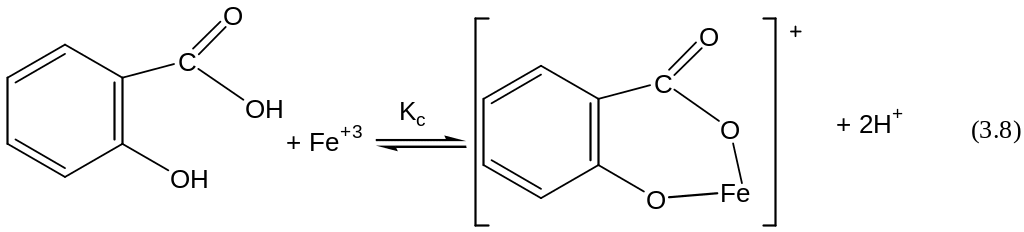
Указанная реакция является суммарной. В растворе протекают ряд последовательных реакций:
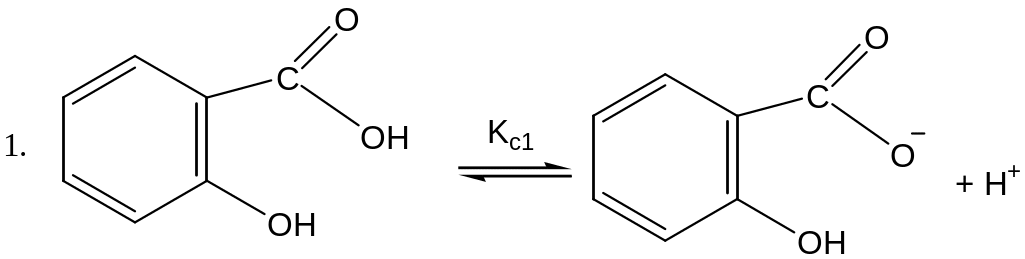
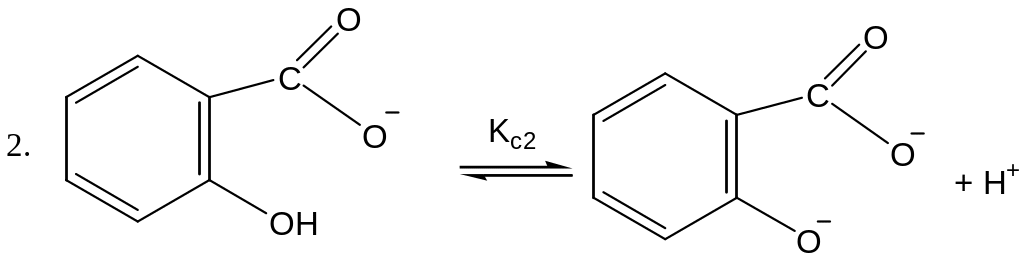

Если константы равновесия указанных реакций обозначить соответственно Кс1, Кс2, Кс3, то между ними существует соотношение:
Кс = Кс1 ∙ Кс2 ∙ Кс3, (3.9)
Константы диссоциации салициловой кислоты в воде по первой (Кс1) и второй (Кс2) ступени известны и при температуре 25оС равны 1,0∙10-3 и 4,0∙10-14 соответственно.
Экспериментально определенная величина Кс и известные значения констант Кс1 и Кс2 позволяют вычислить Кс3, а также обратную ей величину константу нестойкости (Кн) комплексного иона
![]() (3.10)
(3.10)
Для реакции (3.8) в состоянии равновесия при условии постоянства температуры константа равновесия Кс определяется из следующего выражения:
![]() (3.11)
(3.11)
где СН+, Скомпл., СFe3+ и Ссалиц.к-ты – равновесные концентрации продуктов реакции и исходных веществ. Если исходные концентрации салициловой кислоты и FeCl3 С’салиц.к-ты и С’Fe3+, то учитывая стехиометрию реакции можно записать:
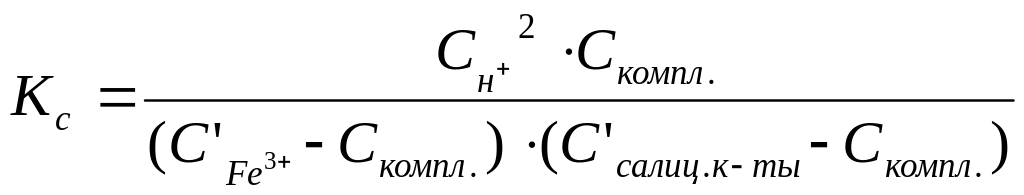 (3.12)
(3.12)
Ионы водорода в реакционной смеси присутствуют в избытке и можно принять, что их концентрация не изменяется, поэтому задача определения константы равновесия Кс сводится к определению равновесной концентрации комплексного иона
Задания:
1. Определить равновесные концентрации железо-салицилового комплекса.
2. Рассчитать константу равновесия реакции образования комплексного иона (Кс) и константу нестойкости комплексного иона (КН).
3. Рассчитать изобарно-изотермический потенциал (GоТ).