
- •Федеральное агентство по образованИю государственное образовательное учреждение высшего профессионального образования «московский государственный текстильный университет имени а.Н.Косыгина»
- •Методические указания к лабораторным работам по дисциплине «Физическая химия»
- •Часть 1
- •Содержание
- •1.Методы определения строения молекул
- •Лабораторная работа №1. Определение рефракции и структурной формулы вещества
- •2.Термохимия
- •Лабораторная работа №3. Определение интегральной теплоты растворения соли (безводной и кристаллогидрата) и расчет теплоты гидратации
- •Описание калориметрической установки
- •Порядок работы на калориметре
- •Способы определения теплоемкости калориметрической системы
- •Порядок выполнения работы
- •3. Химическое равновесие
- •Лабораторная работа №4. Определение константы равновесия реакции взаимодействия салициловой кислоты с треххлористым железом в водном растворе
- •Методика проведения работы по определению равновесной концентрации железо-салицилового комплекса
- •Порядок проведения работы:
- •4. Фазовые равновесия в многокомпонентных жидких системах
- •Лабораторная работа №5. Изучение взаимной растворимости жидкостей и фазового равновесия в двухкомпонентной системе
- •Порядок выполнения работы
- •Порядок выполнения работы
Способы определения теплоемкости калориметрической системы
Теплоемкость калориметрической системы Ск – это количество теплоты, необходимое для ее нагревания на 1 град. В данном случае понятие теплоемкость относится не к веществу, а к системе, так как нагревается и стеклянная пробирка, и находящаяся внутри нее соль, и стакан с калориметрической жидкостью, и металлические части калориметра и воздух внутри него.
![]() ,
(2.7)
,
(2.7)
где: Q – количество теплоты, сообщенное системе, Топ – полученное из опыта значение изменения температуры.
Существует 2 способа сообщить системе известное количество теплоты:
а) с помощью электрического нагревателя;
Q = Р∙, Дж (2.8)
где: Р – мощность нагревателя, Вт;
- продолжительность нагревания, с.
![]() ,
Дж/град
(2.9)
,
Дж/град
(2.9)
б) проведение в калориметре процесса с известным тепловым эффектом. Таким процессом может быть растворение соли, например KBr.
![]() ,
Дж/град,
(2.10)
,
Дж/град,
(2.10)
где: Н – интегральная теплота растворения соли (справочная величина зависит от концентрации полученного раствора);
Топ – изменение температуры, вызванное тепловым эффектом Н.
Порядок выполнения работы
Взвешивают на аналитических весах в 2-х пробирках с пробками указанное преподавателем количество соли.
В калориметрические стаканы наливают дистиллированную воду по 200-300 г (по указанию преподавателя). Устанавливают ампулы и стаканы с водой в рабочий и эталонный калориметры.
По указанию преподавателя выбирают один из способов определения Ск и снимают зависимость Т = f(). На основании полученных экспериментальных данных строят график и определяют Топ. При определении Ск с использованием нагревателя последний включают на 1-3 мин после окончания предварительного периода, затем выключают. Этим завершается главный период и продолжают снимать показания в заключительном периоде. Если Ск определяют другим способом, то в пробирки помещают навески стандартной соли (KBr или KCl) и проводят эксперимент по обычной схеме. Для выбора табличного значения теплоты растворения соли предварительно рассчитывают концентрацию образовавшегося раствора стандартной соли. Значения Ск получают из формул (2.9 или 2.10).
Загружают калориметрическую установку пробирками с исследуемой безводной солью и стаканами с дистиллированной водой и снимают зависимость Т = f().
Проводят аналогичный эксперимент с кристаллогидратом соли. Строят графики и определяют значения Топ. Экспериментальные данные заносят в таблицу 2.1.
Таблица 2.1.
Метод определения Ск…… Соль…. Кристаллогидрат….. Масса соли m1 = Масса кристаллогидрата m2= Масса Н2О…. |
|||||
Экспериментальные данные Т = f(), полученные для определения |
|||||
Ск= |
Теплота растворения безводной соли H1= |
Теплота растворения кристаллогидрата H2= |
|||
, с |
Т, оС |
, с |
Т, оС |
, с |
Т, оС |
0 30 60 … 180* 190 200 210 … … …* …. 500 530 … |
|
|
|
|
|
* - Время начала главного периода (отметить, в какой момент времени был включен и выключен обогреватель, или разбита ампула).
Интегральную теплоту растворения безводной соли и ее кристаллогидрата рассчитывают, используя экспериментальные значения Топ1 и Топ2 и полученное ранее значение Ск, где Топ1 и Топ2 – изменение температуры в езультате растворения n1 моль безводной соли и n2 моль ее кристаллогидрата (соответственно):
![]() (2.11)
(2.11)
![]() (2.12)
(2.12)
Затем по закону Гесса вычисляют теплоту образования кристаллогидрата (гидратации) H по экспериментально найденным тепловым эффектам H1 и H2, например:
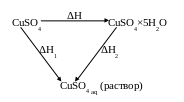
![]()
H1 = H+H2 – по закону Гесса
H = H1 - H2
