
- •Федеральное агентство по образованИю государственное образовательное учреждение высшего профессионального образования «московский государственный текстильный университет имени а.Н.Косыгина»
- •Методические указания к лабораторным работам по дисциплине «Физическая химия»
- •Часть 1
- •Содержание
- •1.Методы определения строения молекул
- •Лабораторная работа №1. Определение рефракции и структурной формулы вещества
- •2.Термохимия
- •Лабораторная работа №3. Определение интегральной теплоты растворения соли (безводной и кристаллогидрата) и расчет теплоты гидратации
- •Описание калориметрической установки
- •Порядок работы на калориметре
- •Способы определения теплоемкости калориметрической системы
- •Порядок выполнения работы
- •3. Химическое равновесие
- •Лабораторная работа №4. Определение константы равновесия реакции взаимодействия салициловой кислоты с треххлористым железом в водном растворе
- •Методика проведения работы по определению равновесной концентрации железо-салицилового комплекса
- •Порядок проведения работы:
- •4. Фазовые равновесия в многокомпонентных жидких системах
- •Лабораторная работа №5. Изучение взаимной растворимости жидкостей и фазового равновесия в двухкомпонентной системе
- •Порядок выполнения работы
- •Порядок выполнения работы
Методика проведения работы по определению равновесной концентрации железо-салицилового комплекса
Равновесную концентрацию железо-салицилового комплекса определяют колориметрическим (спектрофотометрическим) методом. Колориметрические определения основаны на сравнении поглощения при пропускании света стандартным и исследуемым окрашенным раствором.
В основе метода лежит объединенный закон Бугера-Ламберта-Беера, который можно выразить уравнением
D= ∙c∙l, (3.13)
где
D
– оптическая
плотность,
![]() ;
;
Io – интенсивность падающего света;
I – интенсивность светового потока после прохождения света через раствор;
c– концентрация растворенного вещества, моль/л;
l – толщина поглощающего слоя, см;
- молярный коэффициент поглощения света (коэффициент экстинкции).
Молярный коэффициент поглощения света представляет собой оптическую плотность 1М раствора, помещенного в кювету с толщиной слоя 1 см. Он зависит от длины волны падающего света, температуры раствора и природы растворенного вещества и растворителя.
Для измерения оптической плотности используются фотоэлектроколориметры или спектрофотометры различных конструкций. Оптическая схема фотоэлектроколориметра (самого простого прибора для определения оптической плотности) приведена на рис.3.1.









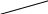







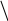
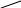



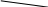
Рис. 3.1. Оптическая схема фотоколориметра KF-77
Световой поток от источника света (1) фокусируется системой линз (2) на кювете с раствором (3). Затем свет проходит через светофильтр (4) и попадает на фотоэлемент (5). Фототок после его усиления регистрируется на гальванометре (6).
Принцип работы фотоэлектроколориметра прост: установка на ноль регистрирующей стрелки прибора при прохождении монохроматического излучения через раствор сравнения («холостой» раствор), чаще всего вода или другой растворитель, и измерение оптической плотности исследуемого раствора после перемещения кюветодержателя в рабочее положение.
Порядок проведения работы:
1. В качестве основных реагентов используют растворы FeCl3 в 10-2М растворе HCl и водные растворы салициловой кислоты.
2. Для определения концентрации железо-салицилового комплекса в реакционной смеси предварительно устанавливают зависимость оптической плотности раствора от его концентрации и строят калибровочный график. Для этого готовят серию растворов FeCl3 в 5,0∙10-2М растворе HCl в избытке салициловой кислоты. Концентрации смешиваемых растворов приведены в таблице 3.1.
Таблица 3.1
№ п/п |
Концентрация растворов FeCl3 в HCl, Со∙103, моль/л |
Концентрация салициловой кислоты, моль/л, Со∙103 |
Оптическая плотность А |
1 |
2 |
3 |
4 |
1 2 3 4 5 6 |
0,25 0,50 0,75 1,00 1,25 1,5 |
7,00 7,00 7,00 7,00 7,00 7,00 |
|
Для приготовления реакционной смеси растворы FeCl3 заданной концентрации сливают с равным объемом салициловой кислоты (например, 2,5 мл раствора FeCl3 в HCl и 2,5 мл салициловой кислоты, общий объем каждой смеси должен составлять 5 мл). Смешение растворов проводят, начиная от меньшей концентрации.
Концентрацию раствора FeCl3 в реакционной смеси рассчитывают по формуле
![]() (3.14)
(3.14)
где Сi - концентрация с поправкой на разбавление раствора при смешении;
Со – концентрация исходного раствора FeCl3;
V1 – объем раствора FeCl3, мл;
V2 – объем раствора салициловой кислоты, мл.
3.Построение градуировочного графика зависимости оптической плотности (А) от концентрации раствора.
Для построения градуировочного графика при длине волны λ=480 нм измеряют оптическую плотность серии стандартных растворов, указанных в табл.3.1. Результаты измерения оптической плотности (А растворов и их концентрацию заносят в таблицу 3.1 графа 4).
Полученные результаты представляют также в виде графика А=f(Ci). Учитывая, что используется избыток салициловой кислоты, можно принять, что концентрация железо-салицилового комплекса в реакционной смеси равна концентрации раствора FeCl3 Сi с поправкой на разбавление раствора при смешении; поэтому на оси абсцисс на графике откладывается концентрация комплекса.
Определение равновесной концентрации железо-салицилового комплекса
Для определения константы равновесия (Кс) образовавшегося при реакции железо-салицилового комплекса готовят серию растворов салициловой кислоты в смеси с FeCl3 в растворе HCl, как указано в таблице 3.2.
Пипетки и кюветы перед приготовлением новой смеси необходимо тщательно промыть исследуемым раствором.
Через 15-20 минут после приготовления исследуемых растворов приступают к колориметрированию. Измерив оптическую плотность исследуемых растворов при длине волны λ=480 нм, определяют по градуировочному графику равновесную концентрацию образовавшегося при реакции железо-салицилового комплекса (Сх).
5. Расчет константы равновесия (Кс) и константы нестойкости (Кн)
Равновесная концентрация исходных веществ в каждой реакционной смеси рассчитывают по формулам: (СFe3+ - Cx) и (Cсал.к-ты – Сх).
Равновесную концентрацию ионов водорода принимают равной исправленной на разбавление концентрации ионов водорода в исходном растворе HCl. Числом водородных ионов, образующихся при диссоциации салициловой кислоты можно пренебречь, так как константа диссоциации салициловой кислоты малая величина.
Подставляя ряд равновесных концентраций Сх (табл. 3.2) в формулу
 (3.15)
(3.15)
рассчитывают константы равновесия для реакционной смеси с разной начальной концентрацией компонентов.
Таблица 3.2.
№ п/п |
Концентрация раствора FeCl3 в HCl Со∙103, моль/л |
Концентрация салициловой кислоты Со∙103, моль/л |
Оптическая плотность D |
Концентрация железо-салицилового комплекса, Сх∙103, моль/л |
1 |
2 |
3 |
4 |
5 |
1 2 3 4 5 |
0,50 0,75 1,00 1,25 1,50 |
6,50 6,00 5,50 5,00 4,50 |
|
|
По известным значения Кс, К1, К2 вычисляют константу нестойкости железо-салицилового комплекса (Кн) по уравнению 3.10 и стандартный изобарно-изотермический потенциал (химическое сродство при температуре T) по уравнению:
GоТ = - RT ln Kс (3.16)
Результаты расчетов представить в таблице 3.3.
Таблица 3.3.
Константа равновесия Кс (сред.) |
Константа нестойкости Кн (среднее) |
GоТ, кДж/моль |
Примечание |
|
|
|
|
