- •Раздел III. Равновесные электродные процессы
- •Величины, характеризующие энергетическое состояние заряженных частиц
- •Эдс как сумма гальвани-потенциалов
- •Эдс как сумма вольта-потенциалов
- •Теория возникновения электродного потенциала и эдс
- •Гальвани-потенциал на границе двух металлов
- •Гальвани-потенциал на границе металл – раствор Осмотическая теория Нернста
- •Сольватационная теория электродного потенциала
- •Классификация электродов
- •Электроды первого рода
- •Электроды второго рода
- •Электроды третьего рода
- •Газовые электроды
- •Амальгамные электроды
- •Окислительно-восстановительные, или редокси-электроды
- •Физические цепи
- •Концентрационные цепи
- •Химические цепи
- •Аккумуляторы
- •Электрокинетические явления
- •Электрокапиллярные явления
- •Потенциалы нулевого заряда и нулевые точки металлов
- •Теория конденсированного двойного слоя Гельмгольца
- •Теория диффузного двойного слоя Гуи – Чапмана
- •Адсорбционная теория Штерна
- •Дальнейшее развитие теории строения дэс
Эдс как сумма гальвани-потенциалов
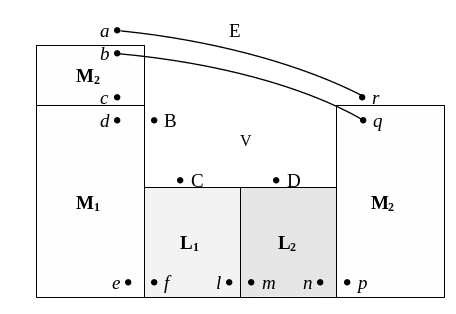
Скачки потенциала могут возникать на границе раздела любых двух фаз, и механизм их образования зависит от природы граничащих фаз. В электрохимической системе можно найти (см. рис. 15):
Твердые металлические фазы (оба электрода и внешняя цепь).
Жидкие фазы (растворы, примыкающие к электродам; они могут давать или две фазы, если электролит растворен в двух несмешивающихся между собой растворителях, или одну фазу, когда растворитель один и тот же).
Газовую фазу (граничит с электродами и с растворами, по свойствам близка к вакууму).
Разность потенциалов между двумя точками определяется той работой, которую необходимо совершить, чтобы перенести элементарный электрический заряд из одной точки в другую. Если обе точки лежат в одной и той же фазе, то работа переноса заряда будет только электрической и потенциал между выбранными точками можно или определить, или вычислить.
В реальном процессе переноса заряда из одной фазы в другую химическая и электрическая работы совершаются одновременно, и определить можно лишь общий энергетический эффект, отвечающий изменению электрохимического потенциала, но не отдельные его слагаемые. Найти экспериментально абсолютную разность электрических потенциалов (скачок потенциала между двумя разными фазами) до сих пор не удалось. ЭДС электрохимической системы, напротив, можно непосредственно измерить; она должна, следовательно, отвечать разности потенциалов между двумя точками, лежащими в одной и той же фазе. Этими точками могут быть точки b и q, находящиеся в одном и том же металле, или точки a и r, расположенные в вакууме вблизи поверхности металла. На рис. 15 изображена правильно разомкнутая электрохимическая цепь, на двух концах которой находится один и тот же металл. Положительное электричество должно проходить по пути M2 M1 L1 L2 M2 . ЭДС системы равна сумме всех скачков потенциала, встречающихся на пути прохождения тока: между точками a и b, c и d, e и f, l и m, n и p, q и r.
Скачки потенциала
между точками a и b,
q и r
– поверхностные потенциалы между
металлом М и вакуумом V:
![]() и
и
![]() (
=
–
).
Точки c и d,
e и f,
n и p
– это места, где локализуются разности
внутренних потенциалов
(
=
–
).
Точки c и d,
e и f,
n и p
– это места, где локализуются разности
внутренних потенциалов
![]() ,
,
![]() ,
,
![]() .
Скачок потенциала между точками l
и m является
гальвани-потенциалом между растворами
.
Скачок потенциала между точками l
и m является
гальвани-потенциалом между растворами
![]() .
Здесь следует различать два случая.
Если растворы L1 и
L2 отвечают двум
несмешивающимся растворителям, то
будет гальвани-потенциалом между двумя
жидкостями или фазовым жидкостным
потенциалом. Если же растворы L1
и L2 отличаются друг
от друга природой или концентрацией
электролита, но не природой растворителя,
то этот потенциал будет диффузионным
потенциалом; его обозначают обычно как
d
.
.
Здесь следует различать два случая.
Если растворы L1 и
L2 отвечают двум
несмешивающимся растворителям, то
будет гальвани-потенциалом между двумя
жидкостями или фазовым жидкостным
потенциалом. Если же растворы L1
и L2 отличаются друг
от друга природой или концентрацией
электролита, но не природой растворителя,
то этот потенциал будет диффузионным
потенциалом; его обозначают обычно как
d
.
|
Рис. 15. Характеристика электрохимической системы с указанием локализации возможных скачков потенциала: М1 и М2 – металлы электродов, L1 и L2 – растворы, V – газовая фаза |
Таким образом, ЭДС электрохимической системы представляет собой сумму следующих скачков потенциала:
Е =
+
![]() +
+
+
+
+
+
+
+
или, после сокращения одинаковых слагаемых,
Е = + + + .
ЭДС электрохимической системы состоит из четырех скачков потенциала: гальвани-потенциала между двумя металлами, двух нернстовских потенциалов и гальвани-потенциала на границе раствор – раствор. Во многих электрохимических системах потенциал или отсутствует, или его можно свести до минимума; он не является неизбежным следствием природы электрохимической системы и обязательным слагаемым ее ЭДС. Поэтому ЭДС обычно выражают как сумму трех гальвани-скачков потенциала:
Е =
+
![]() +
+
![]() .
.
Наконец, разность
потенциалов между точками а и В
представляет собой вольта-потенциал
между металлами М2 и М1 (![]() ),
а разность потенциалов в точках В и С
является вольта-потенциалом между
металлом М1 и раствором L1
(
),
а разность потенциалов в точках В и С
является вольта-потенциалом между
металлом М1 и раствором L1
(![]() ).
).