- •Раздел III. Равновесные электродные процессы
- •Величины, характеризующие энергетическое состояние заряженных частиц
- •Эдс как сумма гальвани-потенциалов
- •Эдс как сумма вольта-потенциалов
- •Теория возникновения электродного потенциала и эдс
- •Гальвани-потенциал на границе двух металлов
- •Гальвани-потенциал на границе металл – раствор Осмотическая теория Нернста
- •Сольватационная теория электродного потенциала
- •Классификация электродов
- •Электроды первого рода
- •Электроды второго рода
- •Электроды третьего рода
- •Газовые электроды
- •Амальгамные электроды
- •Окислительно-восстановительные, или редокси-электроды
- •Физические цепи
- •Концентрационные цепи
- •Химические цепи
- •Аккумуляторы
- •Электрокинетические явления
- •Электрокапиллярные явления
- •Потенциалы нулевого заряда и нулевые точки металлов
- •Теория конденсированного двойного слоя Гельмгольца
- •Теория диффузного двойного слоя Гуи – Чапмана
- •Адсорбционная теория Штерна
- •Дальнейшее развитие теории строения дэс
Электрокапиллярные явления
На границе раздела двух фаз можно выделить пограничный слой, так называемую поверхностную или пограничную фазу. Она обладает избытком свободной энергии по сравнению с каждой из граничащих фаз. Эта избыточная энергия, отнесённая к единице поверхности раздела фаз, то есть удельная свободная энергия s, имеет размерность Дж×м–2 или Н×м–1. В случае границы двух жидких фаз, например жидкого металла (ртути, амальгам, галлия) и раствора, удельная свободная энергия s совпадает с поверхностным или пограничным натяжением g, имеющим ту же размерность, что и s.
Поверхностная фаза отличается от граничащих фаз не только энергетически, но и во многих других отношениях, в частности по составу. Содержание компонентов в поверхностной фазе может быть существенно иным, чем в объёме фаз. Подобное изменение состава является следствием взаимодействия частиц раствора с поверхностью твёрдого или жидкого металла и характеризует процесс адсорбции.
В зависимости от природы сил взаимодействия различают физическую (электростатическую) адсорбцию, вызванную чисто кулоновским взаимодействием, специфическую, когда, например, ионы адсорбируются на одноимённо заряженной поверхности и обусловленную, в основном, силами Ван-дер-Ваальса, а также хемосорбцию, связанную с образованием химических соединений между адсорбентом (в данном случае металлом) и адсорбатом (в данном случае частицами, находящимися в растворе).
Если концентрация частиц увеличивается по мере приближения к поверхности, то адсорбция называется положительной. Положительная адсорбция может быть обусловлена «выталкиванием» частиц из объема на поверхность. Так ведут себя гидрофобные органические вещества в водных растворах, которые нарушают водородные связи между молекулами воды в объеме раствора. Выигрыш энергии за счет восстановления этих связей при переходе органических молекул на поверхность и служит причиной их «выжимания» из объема раствора. Другой возможной причиной положительной адсорбции является взаимное притяжение между поверхностью электрода и частицами раствора. Это взаимодействие, как уже говорилось выше, может быть чисто электростатическим или специфическим.
Если концентрация частиц убывает по мере приближения к поверхности, то адсорбция называется отрицательной. Отрицательная адсорбция частиц может быть вызвана или втягиванием сильно сольватированных частиц с поверхности в объем раствора, или отталкиванием ионов от одноименно заряженной поверхности электрода. Первый эффект приводит к заметной отрицательной адсорбции только в концентрированных растворах (1 моль/л), в то время как отталкивание ионов от одноименно заряженной поверхности электрода вызывает существенную отрицательную адсорбцию и в разбавленных растворах.
Итак, в результате адсорбции в поверхностной фазе оказывается избыточное (или недостаточное) количество частиц определённого вида (или определённых видов), называемое обычно поверхностным избытком i-го компонента (или i-х компонентов) Гi . Он определяется как суммарное превышение концентрации данного компонента в поверхностной фазе над концентрацией того же компонента в объёме раствора, отнесённое к единице поверхности раздела, то есть имеет размерность моль×м–2 . Величину Гi можно определить также как количество данного компонента i , которое нужно ввести в систему (или, наоборот, вывести из системы, если Гi 0) для того, чтобы при увеличении поверхности раздела фаз на единицу состав объемных фаз остался без изменения.
Как поверхностная энергия, так и поверхностные избытки зависят от разности потенциалов на границе раздела фаз.
Следует различать понятия поверхностного избытка Гi и поверхностной концентрации Аi , то есть количества компонента i , непосредственно связанного с единицей поверхности электрода. Обе величины (Гi и Аi ) имеют одинаковую размерность (моль/м2 ), однако поверхностная концентрация – величина всегда положительная, тогда как поверхностный избыток может быть как положительным, так и отрицательным.
Электрокапиллярные явления отражают связь, существующую между поверхностным натяжением и разностью потенциалов на границе двух фаз. Графически эта связь выражается в виде электрокапиллярных кривых (э.к.к.). Впервые электрокапиллярные явления были изучены на границе ртути и водных растворов электролитов Липпманом (1875), который использовал для этой цели сконструированный им капиллярный электрометр.
При снятии электрокапиллярных кривых на ртутный микроэлектрод, находящийся в капилляре и контактирующий с раствором, подаётся определённый потенциал и измеряется высота столба ртути, удерживаемого в стеклянной трубке над ртутным мениском в капилляре. Потенциал на границе между раствором и ртутью в капилляре задаётся наложением определённой ЭДС (например, от потенциометрической установки) на электрохимическую систему, в которой одним электродом служит капиллярный электрод, а другим – соответствующий электрод сравнения с известным значением потенциала. Как это следует из теории капиллярности, высота ртутного столба над ртутным мениском в капилляре является мерой поверхностной энергии на границе ртуть – раствор. Соотношение между этими двумя величинами можно записать в виде уравнения
2 p r s = p h r2 g r ,
откуда
s
=
![]() r g
r ,
r g
r ,
где r – радиус капилляра; g – ускорение силы тяжести; r – плотность ртути. Измеряя высоту h при различных значениях потенциала и рассчитывая по уравнению соответствующие ей значения s, можно построить электрокапиллярную кривую.
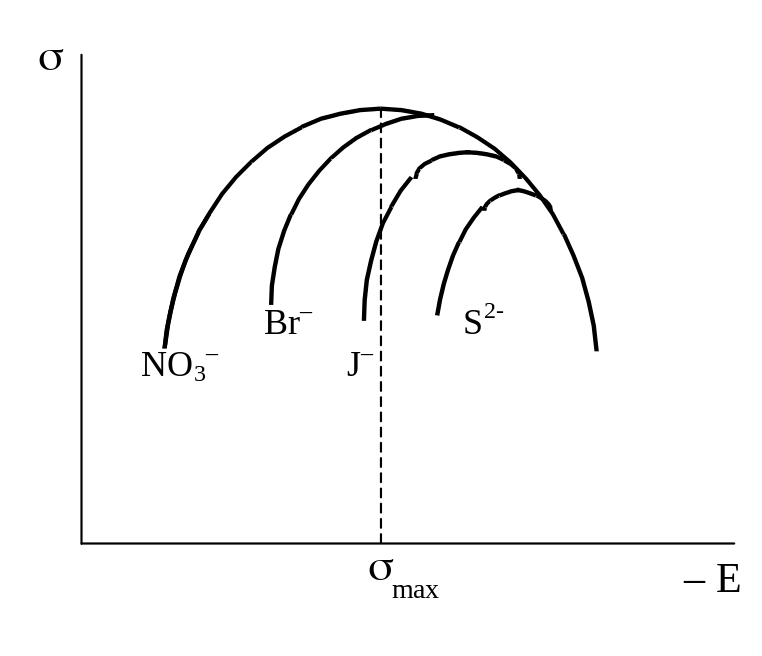
Для ряда разбавленных растворов (например, H2SO4, КОН, KNO3, Na2SO4 и др.) форма электрокапиллярной кривой почти не зависит от природы электролита и близка к параболе. Максимум на кривой наблюдается почти при одном и том же значении потенциала, лежащем между – 0,19 и – 0,21В по водородной шкале. Поверхностное натяжение в точке максимума также мало изменяется при переходе от одного из указанных растворов к другому и составляет 0,42-0,43 Дж×м–2. В то же время электрокапиллярные кривые, полученные в растворах других электролитов, а также в присутствии большинства органических неионизированных веществ, весьма заметно отличаются по своей форме от параболы. Они менее симметричны и их максимумы расположены при иных значениях E и s (см. рис. 19).
Присутствие ионов брома, йода или серы смещает максимум электрокапиллярной кривой в сторону более отрицательных значений потенциалов и (особенно в области потенциалов, расположенных слева от точки максимума) уменьшает поверхностное натяжение. При достаточно отрицательных потенциалах эффект этих анионов исчезает и электрокапиллярные кривые сливаются друг с другом. Присутствие ионов таллия или ионов тетрабутиламмония сдвигает максимум электрокапиллярных кривых в сторону более положительных значений и уменьшает поверхностное натяжение; особенно заметно это при потенциалах более отрицательных, чем потенциал точки максимума. По достижении достаточно положительных потенциалов эффект этих катионов исчезает. Присутствие амилового спирта изменяет форму электрокапиллярной кривой главным образом в области потенциалов, примыкающих к потенциалу максимума. С удалением в обе стороны от потенциала электрокапиллярного максимума эффект добавки амилового спирта снижается и кривая, снятая с добавкой спирта, совпадает с кривой для чистого раствора. Ионные или молекулярные соединения, оказывающие подобное действие, называются специфически адсорбирующимися или поверхностно-активными ионами или молекулами.
|
|
|
Рис. 19. Электрокапиллярные кривые, снятые в растворах, содержащих поверхностно-активные анионы (а), катионы (б) и молекулярные вещества (в) |
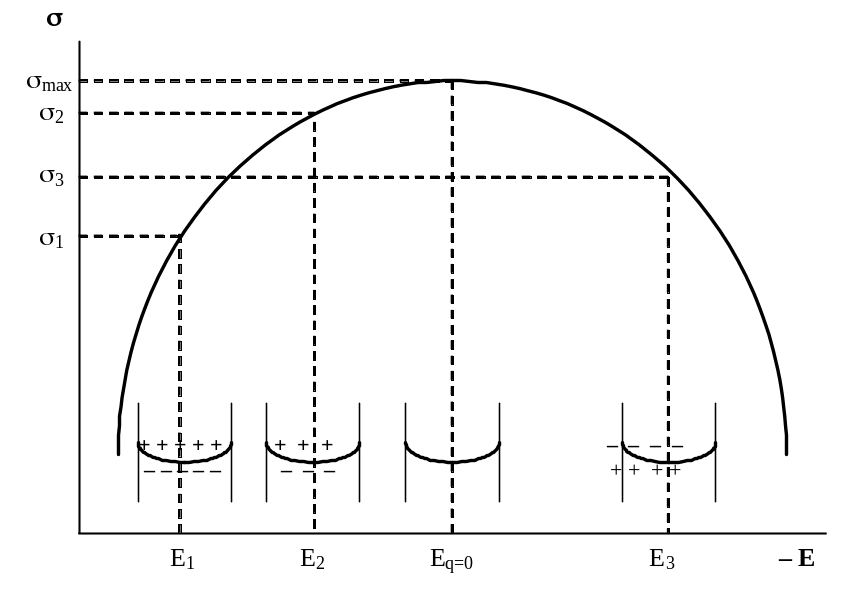
Электрокапиллярные свойства границы ртуть – раствор электролита можно объяснить, если допустить, что в отсутствие внешней ЭДС ртуть при потенциале E1 оказывается заряженной положительно по отношению к раствору. Поэтому со стороны раствора у границы раздела будет избыток отрицательных ионов. Присутствие одноимённо (положительно) заряженных ионов ртути на поверхности металла неизбежно приводит к появлению отталкивающих сил, и поверхностное натяжение на границе ртуть – раствор не может быть высоким; оно отвечает некоторой величине s1 (см. рис. 20). При наложении внешней ЭДС потенциал ртути смещается вследствие её катодной поляризации в сторону более отрицательных значений, например, до величины E2 . Часть ионов ртути при этом нейтрализуется электронами, и её заряд, оставаясь положительным, соответственно снижается. Это уменьшает силы отталкивания между поверхностными ионами ртути, а следовательно, повышает поверхностное натяжение, например, до величины s2 ; одновременно уменьшается число отрицательных ионов, притянутых к поверхности ртути со стороны раствора. При определённом значении потенциала E = Eq=0 положительные заряды всех ионов ртути будут скомпенсированы электронами и заряд поверхности ртути станет равным нулю; одновременно (если в растворе нет поверхностно-активных частиц) заряд раствора также станет равным нулю и поверхностное натяжение достигает максимального значения smax . При дальнейшем смещении потенциала ртути в отрицательную сторону до величины E3 на её поверхности появляются избыточные электроны, к которым со стороны раствора притягиваются положительно заряженные ионы. Снова возникают силы отталкивания между одноимённо заряженными, но теперь уже отрицательными частицами, и поверхностное натяжение упадёт до некоторой величины s3. По мере увеличения отрицательного значения потенциала избыточный отрицательный заряд ртути будет увеличиваться, а поверхностное натяжение уменьшаться. Восходящая ветвь электрокапиллярной кривой относится, таким образом, к положительно, а нисходящая – к отрицательно заряженной поверхности ртути.
|
Рис. 20. Изменение заряда поверхности ртути при переходе от восходящей ветви электрокапиллярной кривой к нисходящей |
Если исходить из предположения, что адсорбция ионов на ртути определяется исключительно электростатическими силами, то все анионы должны изменять ход лишь восходящей ветви электрокапиллярной кривой, где поверхность ртути заряжена положительно. Напротив, влияние катионов должно локализоваться только на нисходящей ветви, где они электростатически притягиваются к отрицательно заряженной поверхности ртути. В действительности, как это было найдено ещё Гуи, многие анионы изменяют ход электрокапиллярной кривой справа от точки максимума, а некоторые катионы влияют не только на нисходящую, но и на восходящую ветвь кривой. Такое поведение ионов нельзя объяснить действием только кулоновских сил. Оно связано с силами взаимодействия, отличными от простых электростатических сил. Такими силами, специфическими для данного рода частиц, могут быть, например, силы Ван-дер-Ваальса или химические (валентные). Благодаря этим силам ионы в состоянии удерживаться на одноимённо заряженной поверхности ртути. Точно так же нельзя на основе одних только электростатических представлений объяснить влияние неионизированных органических веществ на ход электрокапиллярных кривых. Большинство органических веществ обладает меньшей диэлектрической постоянной, чем вода, и поэтому должны были бы изгоняться ею из двойного слоя уже при незначительных зарядах подобно тому, как диэлектрик с меньшей диэлектрической постоянной вытесняется из заряженного конденсатора диэлектриком с большей диэлектрической постоянной. В этом случае эффект органических веществ должен был бы проявляться только в очень узкой области потенциалов, непосредственно примыкающих к максимуму, электрокапиллярной кривой. В действительности, изменение формы электрокапиллярной кривой под действием органических веществ наблюдается даже при потенциалах, удалённых на 0,5-0,8 В в обе стороны от потенциала максимума электрокапиллярной кривой, то есть здесь должны проявляться какие-то специфические силы.
Лекция 11
Основы теории электрокапиллярных явлений. Потенциалы нулевого заряда и нулевые точки металлов
Уравнение –
![]() = qHg
,
= qHg
,
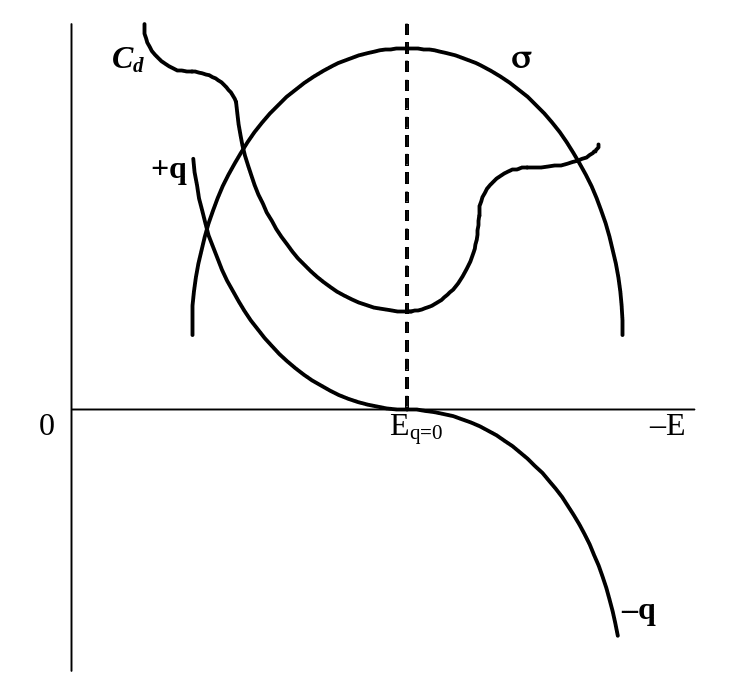
хорошо описывающее форму электрокапиллярных кривых и устанавливающее связь между поверхностным натяжением, потенциалом и зарядом на границе ртуть – раствор, называется первым уравнением Липпмана. Это уравнение определяет наклон в любой точке электрокапиллярной кривой, взятый с обратным знаком, как величину, равную удельному заряду поверхности ртути при данном значении потенциала E. Из уравнения следует, что на восходящей ветви кривой qHg > 0 (dE всегда < 0, на восходящей ветви ds > 0, отсюда – ds/dE > 0), в точке максимума qHg = 0 (так как ds/dE = 0), а на нисходящей ветви qHg < 0 (– ds/dE < 0).
Первое уравнение Липпмана позволяет по экспериментальным э.к.к. вычислить заряд при любом значении потенциала и построить кривые заряд поверхности ртути – потенциал. Так как заряд поверхности ртути можно измерить непосредственно, то имеется возможность проверить справедливость формулы Липпмана. Для этого нужно сопоставить расчетные и экспериментальные значения заряда. Такая проверка была осуществлена А.Н.Фрумкиным. Полученные результаты показали количественную применимость уравнения Липпмана к электрокапиллярным кривым.
Поскольку первое уравнение Липпмана определяет величину заряда независимо от его происхождения, оно приложимо к э.к.к., полученным в любых растворах, в том числе и в растворах, содержащих ПАВ. При одном и том же потенциале и заряд, и его знак могут быть различными в зависимости от природы присутствующих в растворе частиц (см. рис. 19, а: в растворе KNO3 заряд отрицательный, в растворе KBr равен 0, а в растворах KJ и K2S – положительный). Таким образом, анализ э.к.к., так же как и данные, полученные при изучении электрокинетических явлений, указывают на возможность перезарядки поверхности металла в присутствии ПАВ при сохранении неизменной общей величины скачка потенциала между металлом и раствором.
Известно, что производная от заряда по потенциалу дает дифференциальную емкость Cd , то есть величину, характеризующую изменение заряда с потенциалом:
![]() = Cd
.
= Cd
.
Из этого выражения и первого уравнения Липпмана следует второе уравнение Липпмана:
–
![]() =
= Cd
;
=
= Cd
;
dq = Cd
dE ;
![]() =
=
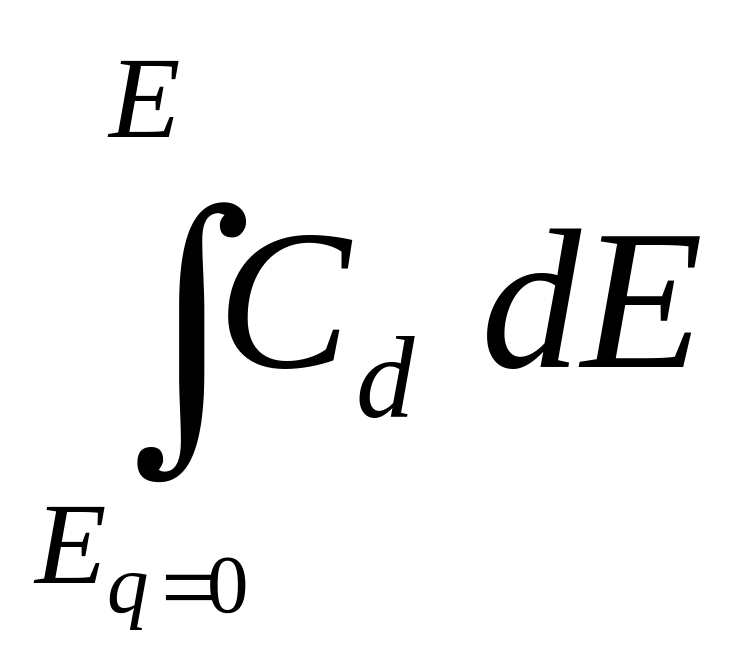 .
.
Так как в точке максимума э.к.к. q = 0, a E = Eq=0 , то интегрирование дает
q = C
(E – Eq=0
) , C =
![]() ,
,
где С – интегральная емкость при потенциале E. Связь между величинами С и Cd передается уравнениями
Cd
= С + (E – Eq=0
)
![]() ; С =
; С =
![]() .
.
|
Рис. 21. Изменение с потенциалом Е поверхностного натяжения s, заряда поверхности металла q и емкости двойного слоя С на границе раздела ртуть – раствор поверхностно-инактивного электролита |
По кривым дифференциальная емкость – потенциал, которые сравнительно легко получаются экспериментально не только на ртути, но и на твердых металлах, можно последовательным интегрированием определить заряд электрода
q =
и поверхностную энергию
s
= const –
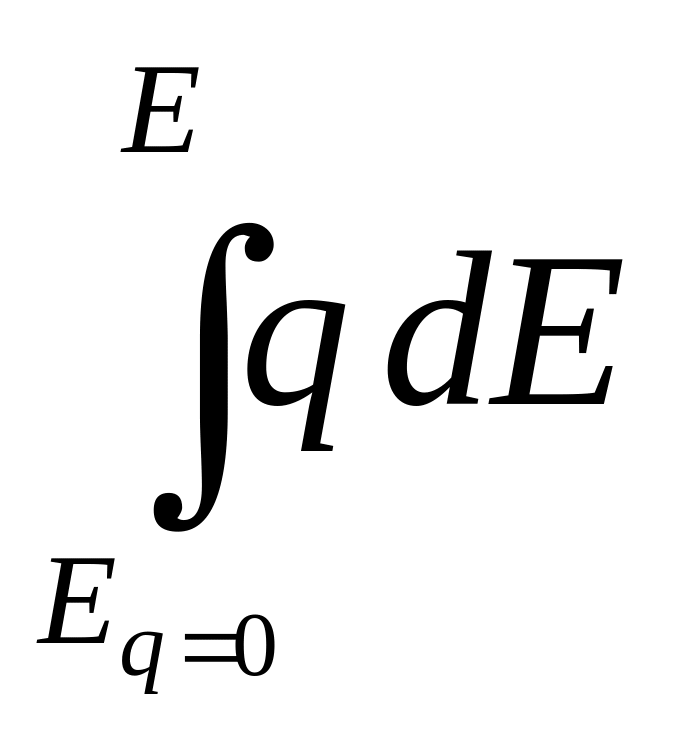 ,
,
const = smax при потенциале нулевого заряда (в точке максимума э.к.к.).
Поверхностное натяжение является функцией состава раствора. Эта зависимость была математически выражена Гиббсом на основании термодинамики поверхностной фазы. Запишем уравнение Гиббса – Дюгема для поверхностной фазы:
Vdр
– SdT – sds
– å
ni
d![]() = 0 .
= 0 .
При р, Т = const
– sds – å ni d = 0 .
Разделим левую часть уравнения на площадь поверхности раздела s и получим
– ds – å Гi d = 0 или ds = – å Гi d .
Это уравнение называется адсорбционной формулой Гиббса или изотермой адсорбции Гиббса.
= mi + qi j , d = dmi + qi dj = dmi + qi dE ;
– ds – q dE – å Гi dmi = 0 или ds = – q dE – å Гi dmi ,
где q = å qi . Вышеприведенное уравнение является основным уравнением электрокапиллярности. Зная поверхностные избытки, можно, используя это уравнение, определить заряд поверхности металла, а затем и емкость ДЭС. И наоборот, электрокапиллярные измерения позволяют определить поверхностные избытки компонентов раствора. Из этого уравнения, при условии постоянства состава раствора (dmi = 0), получается первое уравнение Липпмана (уточненное):
![]() = – q .
= – q .

 а
а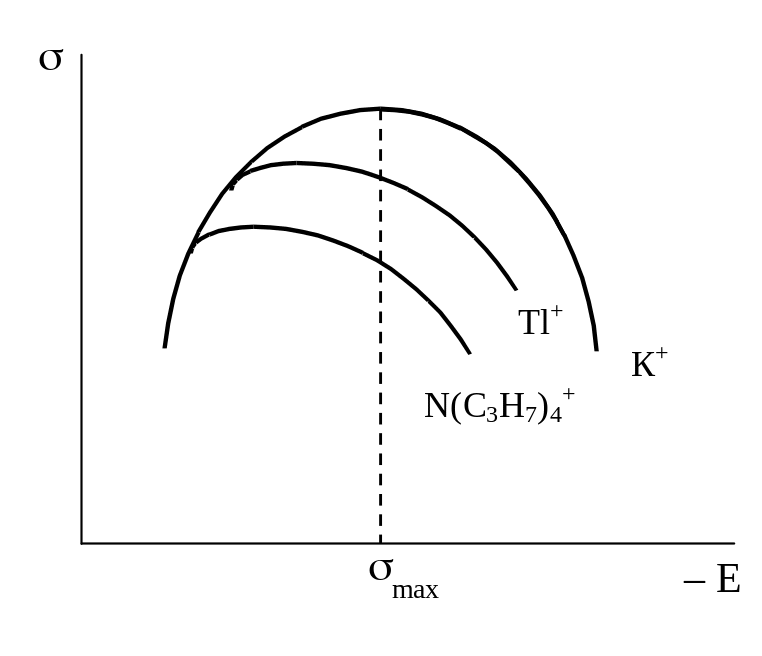 б
б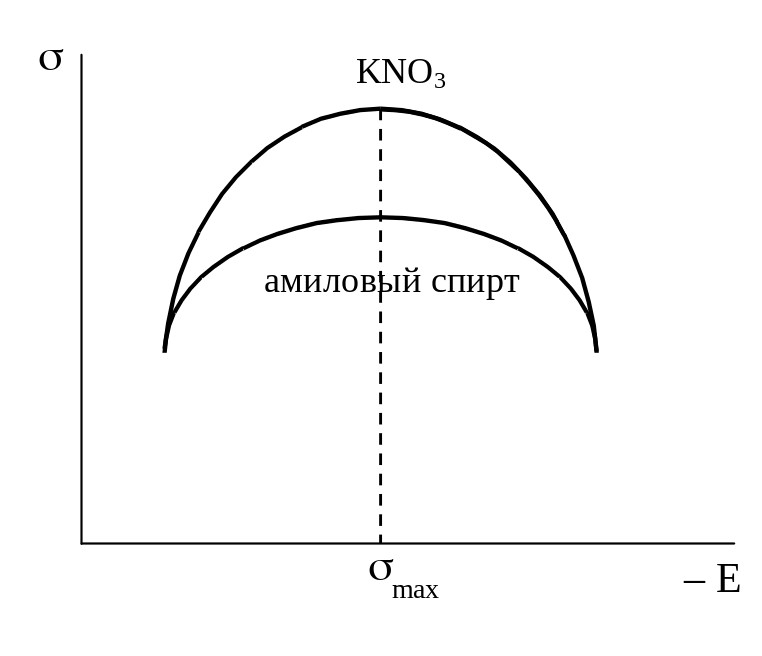 в
в