
- •Раздел III. Равновесные электродные процессы
- •Величины, характеризующие энергетическое состояние заряженных частиц
- •Эдс как сумма гальвани-потенциалов
- •Эдс как сумма вольта-потенциалов
- •Теория возникновения электродного потенциала и эдс
- •Гальвани-потенциал на границе двух металлов
- •Гальвани-потенциал на границе металл – раствор Осмотическая теория Нернста
- •Сольватационная теория электродного потенциала
- •Классификация электродов
- •Электроды первого рода
- •Электроды второго рода
- •Электроды третьего рода
- •Газовые электроды
- •Амальгамные электроды
- •Окислительно-восстановительные, или редокси-электроды
- •Физические цепи
- •Концентрационные цепи
- •Химические цепи
- •Аккумуляторы
- •Электрокинетические явления
- •Электрокапиллярные явления
- •Потенциалы нулевого заряда и нулевые точки металлов
- •Теория конденсированного двойного слоя Гельмгольца
- •Теория диффузного двойного слоя Гуи – Чапмана
- •Адсорбционная теория Штерна
- •Дальнейшее развитие теории строения дэс
Аккумуляторы
Любая электрохимическая цепь в принципе может служить источником электрического тока. По разным причинам (малая электрическая емкость, малая скорость и необратимость химических реакций, физические изменения электродов при эксплуатации и т.д.) большая часть цепей не может быть практически использована для получения электрического тока, и лишь немногие имеют прикладное значение в качестве химических источников тока.
Химические источники тока делятся на источники тока одноразового действия (гальванические элементы) и многоразового действия (аккумуляторы). В аккумуляторах при пропускании через них тока от внешней цепи (заряжение) происходят химические изменения в электродах и растворах, близких к обратимым, и работа электрического тока аккумулируется (запасается) в форме свободной энергии продуктов реакции. Заряженный аккумулятор дает ток при разряжении, после чего вновь может быть заряжен.
Наиболее широко используют кислотный свинцовый, щелочной кадмиево-никелевый и щелочной серебряно-цинковый аккумуляторы.
Свинцовый аккумулятор в заряженном состоянии представляет собой элемент
() Pb PbSO4 H2SO4 (32-34 %) PbO2 Pb (+) .
Здесь имеется два электрода второго рода: свинцово-сульфатный, обратимый по отношению к сульфат-ионам, и свинцово-диоксидный, обратимый по отношению к гидроксильным ионам, а следовательно, и к ионам водорода (как всякий металлоксидный электрод).
При работе аккумулятора протекают следующие электродные реакции:
на левом электроде (свинцово-сульфатном)
Pb
+ SO42–
![]() PbSO4
(т)
+ 2е
;
PbSO4
(т)
+ 2е
;
на правом электроде (свинцово-диоксидном)
PbO2 (т) + 4H+ + SO42– + 2e PbSO4 (т) + 2H2O .
Суммарная реакция в цепи
Pb + PbO2 (т) + 4H+ + 2SO42– 2 PbSO4 (т) + 2H2O ,
![]()
откуда ЭДС цепи равна
Е
= Ео
+
ln
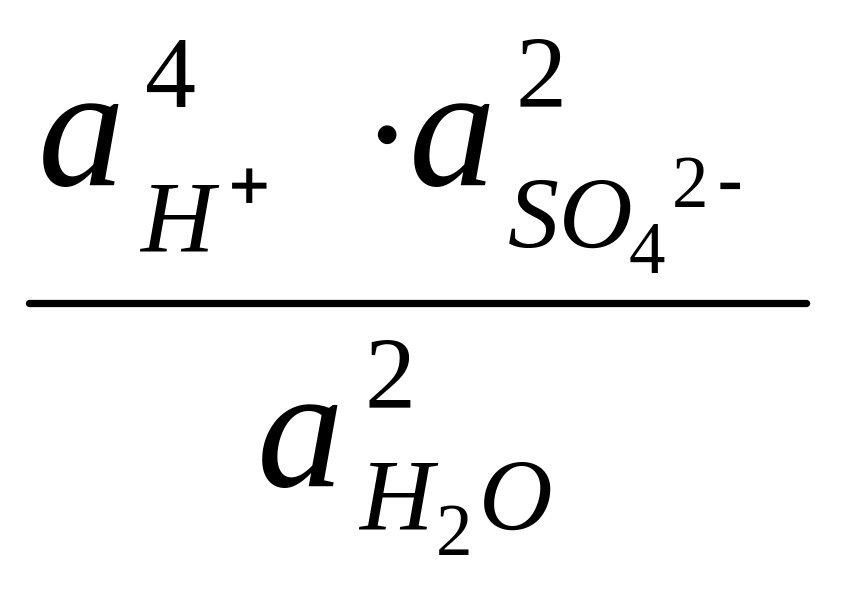 = Ео
+
ln
= Ео
+
ln
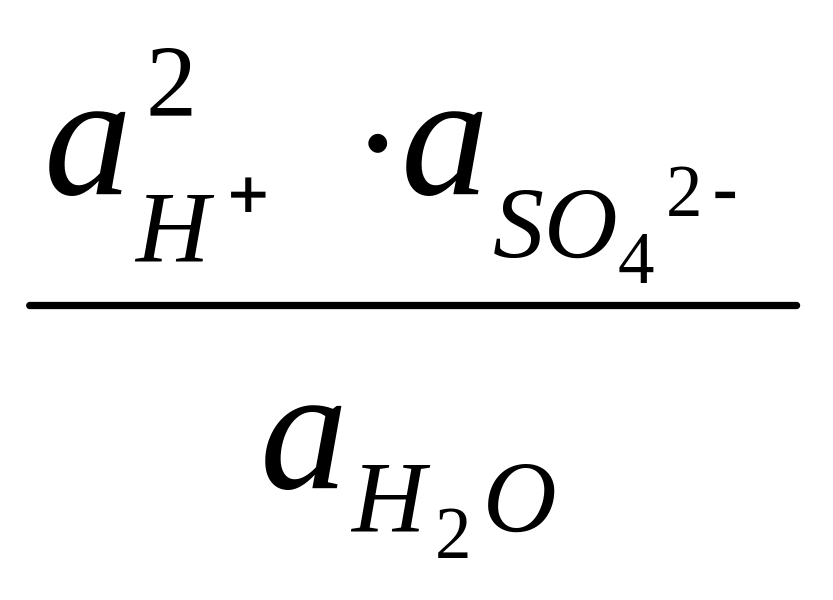 = Ео
+
ln
= Ео
+
ln
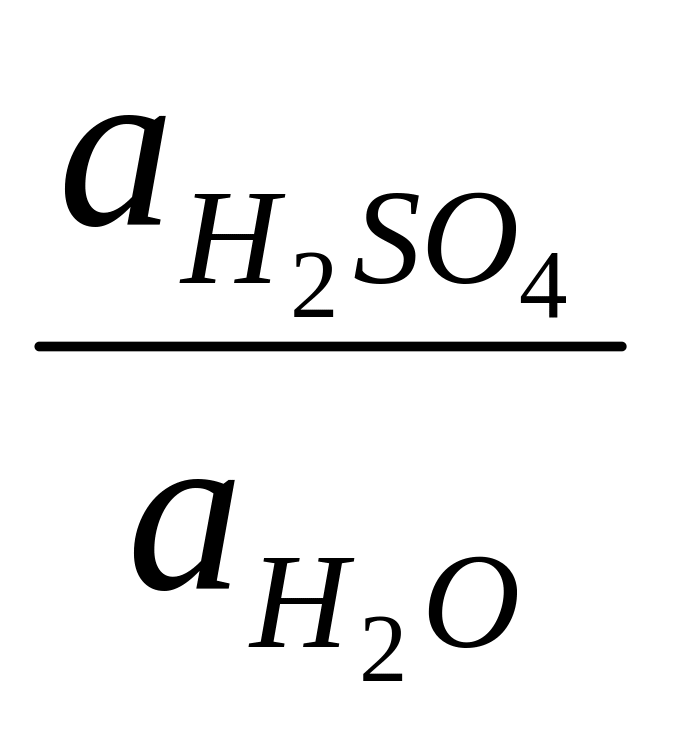
(поскольку
![]()
общей активности серной кислоты).
общей активности серной кислоты).
При 25оС Е = 2,04 + 0,059 lg .
В свинцовых аккумуляторах применяются концентрированные растворы серной кислоты, поэтому активность воды здесь не будет постоянной и ее нельзя включать в величину Ео .
Токообразующие процессы отвечают теории двойной сульфатации Гладстона и Трайба. По этой теории оба электрода при разряде переходят в сульфат свинца. Когда они становятся одинаковыми по своему химическому составу, то есть превращаются в электроды второго рода SO42– PbSO4 Pb , ЭДС цепи падает до нуля. Продукт электродных реакций твердый сульфат свинца обладает способностью удерживаться на поверхности электродов. Поэтому при прохождении тока в обратном направлении (при подключении внешнего источника тока) реакции идут справа налево, в сторону регенерации исходных веществ металлического свинца и диоксида свинца. После регенерации электрохимическая цепь снова может стать источником электрической энергии. Такие циклы разряда и заряда могут повторяться много раз, и после каждого нового заряда восстанавливается исходное состояние системы.
Рассмотренная цепь была первым аккумулятором; идея его создания была высказана Якоби и осуществлена в 1859 г. Планте. В ХХ веке были предложены щелочные аккумуляторы: железо-никелевый (Эдиссон), кадмий-никелевый (Юнгер) и цинк-серебряный (Андре).
Кадмиево-никелевый аккумулятор в заряженном состоянии представляет собой электрохимический элемент
() Cd Cd(OH)2 KOH (20%) Ni(OH)2 , Ni(OH)3 Ni (+) .
Суммарная реакция в этом элементе
Cd + 2Ni(OH)3 Cd(OH)2 + 2Ni(OH)2 .
Значение G для этой реакции не должно зависеть от концентрации щелочи, так как в суммарной реакции участвуют только твердые вещества. Однако реакции на электродах сопровождаются изменением концентрации щелочи и образованием разности концентраций у двух электродов:
Cd + 2OH– Cd(OH)2 + 2e ,
2Ni(OH)3 + 2e 2Ni(OH)2 + 2OH– .
Тем не менее, в результате естественного перемешивания в условиях близости электродов эта разность концентраций практически не возникает. ЭДС кадмиево-никелевого аккумулятора равна приблизительно 1,36 В.
Железо-никелевый аккумулятор. В этом щелочном аккумуляторе кадмий и гидроксид кадмия заменены железом и оксидом железа (II).
Серебряно-цинковый аккумулятор. Анодом является пористая цинковая пластинка, катодом окислы серебра Ag2O и AgO. Электролит концентрированный раствор КОН, насыщенный цинкатом калия Zn(OK)2. Заряженный аккумулятор может быть представлен в виде
() Zn Zn(OK)2 , KOH (40%) AgO или Ag2O Ag (+) .
Суммарная реакция в этом элементе
AgO + Zn ZnO + Ag .
Процесс идет в две стадии: AgO восстанавливается сначала до Ag2O, затем до металлического серебра. ЭДС элементов с катодом AgO равна 1,86 В, с катодом Ag2O 1,58 – 1,60 В (при 25оС). После разряда аккумулятора имеем
() Zn ZnO Zn(OK)2 , KOH (40%) Ag (+) .
В этих аккумуляторах в отличие от свинцовых и щелочных электролит в реакциях заряда и разряда не участвует, поэтому его можно брать очень мало. Это позволило создать аккумуляторы, имеющие очень эффективную конструкцию: электроды помещены вплотную друг к другу и разделены только тонким слоем целлофана. Весь электролит находится в порах электродов. Серебряно-цинковые аккумуляторы имеют большую емкость, высокую энергию и высокую мощность на единицу массы и объема. Они широко применяются там, где необходимы аккумуляторы небольшого размера.
В заключение этого раздела приведем общий подход, использование которого позволяет избежать рассмотрения гальвани-потенциалов при сопоставлении ЭДС цепей. Этот подход включает следующие положения (правила).
1. ЭДС цепи – это потенциал правого электрода относительно левого.
2. Предполагается, что на правом электроде происходит восстановление (присоединение электрона к участвующему в электродном процессе компоненту), а на левом – окисление (анодный процесс с переходом электрона на металл). Если же в реальной системе происходят обратные процессы, то найденная величина Е окажется отрицательной.
3. Предполагается, что на границе двух растворов в цепях с переносом катионы в количестве t+ + переходят слева направо, а анионы в количестве t– – – справа налево. При противоположном направлении переноса величина Е окажется отрицательной.
4.
Сложение всех процессов с учетом условия
равенства чисел электронов, возникающих
на левом электроде и расходуемых на
правом, получают суммарную химическую
реакцию, для которой G
=
![]() , где индексы i
и j
обозначают незаряженные исходные
вещества и продукты реакции, соответственно.
, где индексы i
и j
обозначают незаряженные исходные
вещества и продукты реакции, соответственно.
5. ЭДС цепи определяют по формуле Е = – G/nF. При этом, если реакция идет самопроизвольно, то G 0 и Е 0. В противном случае G 0 и Е 0.
Лекция 10
Электрокинетические и электрокапиллярные явления
