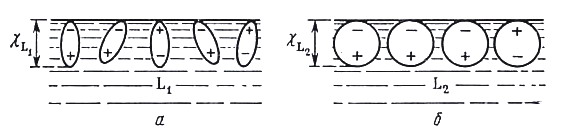- •Раздел III. Равновесные электродные процессы
- •Величины, характеризующие энергетическое состояние заряженных частиц
- •Эдс как сумма гальвани-потенциалов
- •Эдс как сумма вольта-потенциалов
- •Теория возникновения электродного потенциала и эдс
- •Гальвани-потенциал на границе двух металлов
- •Гальвани-потенциал на границе металл – раствор Осмотическая теория Нернста
- •Сольватационная теория электродного потенциала
- •Классификация электродов
- •Электроды первого рода
- •Электроды второго рода
- •Электроды третьего рода
- •Газовые электроды
- •Амальгамные электроды
- •Окислительно-восстановительные, или редокси-электроды
- •Физические цепи
- •Концентрационные цепи
- •Химические цепи
- •Аккумуляторы
- •Электрокинетические явления
- •Электрокапиллярные явления
- •Потенциалы нулевого заряда и нулевые точки металлов
- •Теория конденсированного двойного слоя Гельмгольца
- •Теория диффузного двойного слоя Гуи – Чапмана
- •Адсорбционная теория Штерна
- •Дальнейшее развитие теории строения дэс
Раздел III. Равновесные электродные процессы
Лекция 6
Электрохимический потенциал. Гальвани-потенциал. Вольта-потенциал. ЭДС как сумма гальвани-потенциалов и вольта-потенциалов
Величины, характеризующие энергетическое состояние заряженных частиц
Понятие электрохимического потенциала имеет фундаментальное значение при рассмотрении равновесий на границе фаз с участием заряженных частиц (в частности, на границе электрод – раствор).
Энергетическое состояние заряженной частицы (i) внутри некоторой фазы () характеризуется в общем случае суммой химического потенциала частицы и ее электрической энергии в данной фазе:
![]() =
=
![]() + ziF
(1)
+ ziF
(1)
(верхний индекс означает фазу). – электрохимический потенциал частицы i в фазе ; – разность потенциалов между точкой внутри фазы и бесконечно удаленной точкой в вакууме, ее называют внутренним потенциалом. Работа переноса заряженной частицы из фазы в фазу равна разности электрохимических потенциалов:
–
![]() =
–
=
–
![]() + ziF(
– )
.
+ ziF(
– )
.
При равновесии эта разность равна нулю и
= ,
что является условием равновесия между фазами и , содержащими одинаковые заряженные частицы i.
Величину можно разложить на два слагаемых: внешний и поверхностный потенциалы. Соотношения, существующие между различными видами потенциалов, передаются следующей серией уравнений:
= + , (2)
= + ziF + ziF , (3)
![]() =
+ ziF
= –
=
+ ziF
= –
![]() ,
(4)
,
(4)
= + ziF . (5)
Уравнение
(4) определяет так называемый реальный
потенциал
частицы i
в фазе ,
который можно измерить и который равен
по величине, но обратен по знаку работе
выхода частицы
i
из фазы
(
).
Электрохимический (![]() ),
химический ()
и реальный ()
потенциалы имеют размерность энергии
(Дж; эВ); потенциалы – внутренний (),
поверхностный ()
и внешний ()
– имеют размерность электрического
потенциала (В).
),
химический ()
и реальный ()
потенциалы имеют размерность энергии
(Дж; эВ); потенциалы – внутренний (),
поверхностный ()
и внешний ()
– имеют размерность электрического
потенциала (В).
Физический смысл величин, входящих в уравнения (1) – (5), заслуживает особого внимания. Предположим, что проводящая фаза (металл или раствор электролита) имеет форму сферы и весь ее электрический заряд сосредоточен в тонком поверхностном слое, а заряженная частица i находится в вакууме на бесконечно большом расстоянии от фазы . Если перенести эту частицу внутрь фазы , то затраченная работа (после умножения на число Авогадро) даст величину . Электрохимический потенциал частицы i в фазе равен, таким образом, работе перенесения моля данного компонента из бесконечности в вакууме внутрь данной фазы (рис. 10, а).
|
Рис. 10. Разложение электрохимического потенциала на химическую и электрическую составляющие |
Чтобы разделить эту работу на «химическую» и «электростатическую» составляющие, предположим, что с фазы можно мысленно снять заряженный поверхностный слой (см. рис. 10, б). Если в такую пустую заряженную оболочку внести из бесконечности частицу i с зарядом zi e, то нужно затратить работу zi e. Умножив эту работу на число Авогадро, получим электростатическую составляющую электрохимического потенциала zi F.
Работа
внесения заряженной частицы i
из вакуума внутрь оставшейся незаряженной
сферы, при умножении на число Авогадро,
дает
![]() – химический потенциал частицы i
в фазе
(рис. 10, в).
Химический
потенциал представляет собой энергию
взаимодействия i-той
частицы внутри фазы
с частицами, образующими эту фазу.
– химический потенциал частицы i
в фазе
(рис. 10, в).
Химический
потенциал представляет собой энергию
взаимодействия i-той
частицы внутри фазы
с частицами, образующими эту фазу.
Величина – внутренний потенциал фазы – аддитивно складывается из внешнего потенциала и поверхностного потенциала. Внешний потенциал обусловлен свободными нескомпенсированными зарядами фазы .
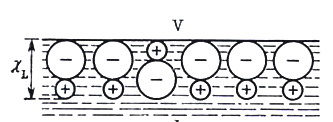
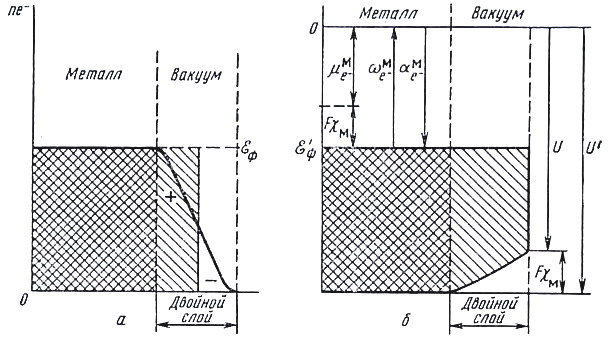
Поверхностный потенциал отражает существование двойного электрического слоя на границе фазы; поверхностный потенциал обусловлен: для растворов – определенной ориентацией находящихся на поверхности диполей растворителя или растворенных ПАВ (см. рис. 11, 12), а на границе металл – вакуум поверхностный потенциал возникает из-за того, что электронный газ частично смещается относительно ионов кристаллической решетки металла и вместе с их положительными зарядами также образует дипольный слой (см. рис. 13). Если свободный электростатический заряд фазы равен нулю, то = 0 и тогда = .
|
Рис. 11. Поверхностные потенциалы L в жидкости L1 (а) и в жидкости L2 (б), образующиеся вследствие ориентированной адсорбции диполей растворителя |
|
Рис. 12. Поверхностный скачок потенциала L , обусловленный избирательной адсорбцией ионов (анионов) |
|
Рис. 13. Модель системы металл – вакуум при температуре, отличной от абсолютного нуля: а – распределение электронов в системе; б – энергетическая характеристика системы |
Определение потенциалов по уравнениям (1) – (5) относится к фазе в вакууме. Если одна фаза граничит с другой, то для характеристики этой границы необходимо ввести новые понятия, поскольку вследствие взаимного влияния фаз поверхность раздела между ними может отличаться по строению и свойствам от свободных поверхностей исходных фаз.
Наряду с внутренними потенциалами фаз появляется необходимость учитывать их разность на границе раздела фаз:
g, = – . (6)
Эта разность называется гальвани-потенциалом. Наряду с внешним скачком потенциала нужно учитывать разность внешних потенциалов открытой части поверхности фаз после частичного (не по всей поверхности) контакта между ними. Эта разность потенциала называется контактным или вольта-потенциалом:
V, = – . (7)
При создании контакта между фазами возникновение скачка потенциала может быть обусловлено разными причинами, во многом зависящими от природы граничащих фаз. Рассмотрим некоторые простейшие примеры установления электрохимического равновесия на границе раздела фаз.
1.
Граница
раздела жидких фаз L1
и L2,
не содержащих заряженных частиц
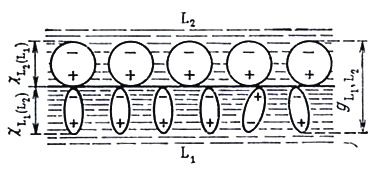
(см. рис. 14). Возникновение скачка
потенциала между фазами (гальвани-потенциала
![]() )
будет обусловлено наложением уже
существовавших поверхностных потенциалов
)
будет обусловлено наложением уже
существовавших поверхностных потенциалов
![]() и
и
![]() .
В результате взаимного влияния частиц,
образующих двойные электрические слои,
возможна перестройка каждого из них с
соответствующим изменением поверхностного
потенциала. В общем случае поверхностные
потенциалы на граничащих фазах не будут
совпадать с поверхностными потенциалами
на исходных открытых поверхностях фаз:
.
В результате взаимного влияния частиц,
образующих двойные электрические слои,
возможна перестройка каждого из них с
соответствующим изменением поверхностного
потенциала. В общем случае поверхностные
потенциалы на граничащих фазах не будут
совпадать с поверхностными потенциалами
на исходных открытых поверхностях фаз:
![]()
![]() ,
,
![]()
.
.
= – .
|
Рис. 14. Гальвани-потенциал на границе двух жидкостей, обусловленный ориентированной адсорбцией диполей жидкостей L1 и L2 |
Одной из наиболее общих причин возникновения скачка потенциала между фазами является обмен заряженными частицами. В момент появления контакта между фазами он протекает преимущественно в каком-то одном направлении, в результате чего создается избыток частиц данного знака заряда по одну сторону границы и их недостаток – по другую. Такой нескомпенсированный обмен приводит к созданию двойного электрического слоя (ДЭС) и к появлению разности потенциалов между фазами. Разность потенциалов, в свою очередь, влияет на кинетику обмена, выравнивая скорость перехода заряженных частиц в обоих направлениях. Наконец, наступает момент, когда уже нет больше преимущественного перехода частиц из одной фазы в другую. Такое значение скачка потенциала отвечает равновесию между фазами, при котором электрохимические потенциалы заряженных частиц в обеих фазах равны.
Заряженными частицами, принимающими участие в обмене между фазами, могут быть положительные и отрицательные ионы и электроны. Какие именно частицы переходят из одной фазы в другую, определяется природой граничащих фаз. На границах металл – вакуум и металл 1 – металл 2 такими частицами являются обычно электроны. На границе металл – раствор соли металла в обмене участвуют катионы металла. На границах стекло – раствор и ионообменная смола – раствор в обмене участвуют два вида одноименно заряженных ионов (например, ионы щелочного металла и водорода). При контакте двух несмешивающихся жидкостей, каждая из которых содержит в растворенном виде один и тот же электролит, потенциал возникает за счет неэквивалентного перехода обоих ионов электролита из одной фазы в другую.
2. Граница двух различных металлов. Происходит выравнивание электрохимических потенциалов электронов в металлах:
е– (М1) е– (М2) .
Условие равновесия имеет вид:
![]() =
=
![]() ,
,
![]() – F
– F![]() =
=
![]() – F
– F![]() ,
,
![]() =
–
= (
–
)
/ F .
=
–
= (
–
)
/ F .
Таким образом, в условиях равновесия работа перенесения электрона из одного металла в другой равна нулю, но работа переноса единицы воображаемого заряда (то есть ) отлична от нуля, так как химические потенциалы электрона в различных металлах неодинаковы.
3. Граница металл – раствор соли металла. При установлении равновесия происходит выравнивание электрохимических потенциалов ионов металла в растворе и в кристаллической решетке металла:
Mz+ (металл М) Mz+ (раствор L) .
При равновесии
![]() =
=
![]() ,
,
![]() + z+FM
=
+ z+FM
=
![]() + z+FL
,
+ z+FL
,
![]() = M
– L
= (
–
)
/ z+F
.
= M
– L
= (
–
)
/ z+F
.
Поскольку
=
![]() + RT ln
+ RT ln
![]() ,
а
= const, уравнение можно
переписать в виде
,
а
= const, уравнение можно
переписать в виде
= const +
![]() ln
.
ln
.
Уравнение аналогичного типа (вместо активности – концентрация) было впервые получено Нернстом. Таким образом, в условиях рассмотренного электрохимического равновесия работа перенесения иона Mz+ из металла в раствор или обратно равна нулю. Гальвани-потенциал зависит от концентрации потенциалоопределяющих ионов Mz+ и также может быть сведен к нулю.
В общем случае гальвани-потенциал между фазами и можно представить как сумму трех слагаемых:
g , = g зар + g адс + g дип ,
где потенциал g зар обусловлен переходом заряженных частиц, g адс – специфической адсорбцией ионов (на одной или обеих поверхностях), а g дип – ориентацией диполей (на одной или обеих поверхностях). Только при отсутствии всех трех эффектов (или их взаимной компенсации) скачок потенциала между двумя фазами оказывается равным нулю.