
- •Техника безопасности при работе в химической лаборатории
- •Физические константы органических веществ
- •Лабораторная работа Определение температуры кипения и показателя преломления неизвестного вещества
- •1. Порядок выполнения работы.
- •2. Образец оформления работы.
- •1) Определение температуры плавления с применением прибора Сиволобова.
- •Лабораторная работа Определение температуры плавления неизвестного вещества с применением прибора Сиволобова
- •1. Порядок выполнения работы.
- •2. Образец оформления работы.
- •1.1. Исследование физических свойств вещества
- •1.2. Проба на свечение пламени
- •1.3. Проба Бельштейна на галоген
- •1.4. Открытие кратной связи
- •1.5. Открытие бензольного кольца
- •1.6. Открытие боковой цепи в бензольном кольце
- •1.7. Открытие галогена в алифатической цепи
- •Аналитическая задача
- •Качественный анализ неизвестного вещества
- •Задача 1
- •1. Исследование физических свойств вещества
- •2. Качественные реакции
- •2.1.Открытие карбоксильной группы
- •2.2. Открытие фенолов.
- •2.3. Открытие карбонильной группы (открытие альдегидов и кетонов).
- •2.4. Открытие спиртов.
- •2.5. Открытие сложного эфира.
- •Идентификация индивидуальных веществ
- •1. Идентификация кислот
- •3. Идентификация альдегидов и кетонов.
- •4. Идентификация спиртов.
- •Аналитическая задача
- •Идентификация неизвестного вещества (образец)
- •Дата Подпись преподавателя Задача 2
- •1.1. Предварительные испытания
- •1.2. Качественные реакции
- •1.2.1. Открытие углеводов реакцией Молиша
- •1.2.2. Открытие моносахаридов реакцией с калий-гидроксидом
- •1.2.3. Открытие альдоз и кетоз реакцией Троммера
- •1.2.4. Открытие кетоз реакцией Селиванова
- •1.3. Идентификация моно- и дисахаридов
- •1.3.1. Фруктоза
- •1.3.2. Ксилоза
- •1.3.3. Глюкоза
- •1.3.4. Мальтоза (солодовый сахар)
- •1.3.5. Сахароза (свекловичный, тростниковый сахар)
- •1.4. Идентификация полисахаридов
- •1.4.1. Амилоза и амилопектин
- •1.4.2. Открытие целлюлозы
- •1.5. Идентификация производных сахаров
- •1.5.1. Сорбит
- •1.5.2. Глюкаровая кислота
- •Аналитическая задача по теме «Углеводы»
- •Дата Подпись преподавателя Задача 3
Идентификация индивидуальных веществ
После определения класса неизвестного вещества проводят его идентификацию с помощью специфических реакций и физических констант: для жидких веществ т. кип. и показатель преломления, для кристаллических температура плавления.
1. Идентификация кислот
Муравьиная кислота НСООН открывается по способности легко окисляться с образованием СО2 и Н2О, так как в отличие от других карбоновых кислот ее можно рассматривать как альдегидо-кислоту. В пробирку помещают 5 капель кислоты, прибавляют 5 капель 20%-ной Н2SO4 (30) и 3 капли 1%-ного раствора KMnO4 (3). Пробирку наклонно закрепляют в штативе и присоединяют газообразную трубку, конец которой должен быть погружен в баритовую воду (34), которая налита в другую пробирку. Смесь осторожно нагревают до кипения. При положительной пробе в первой пробирке быстро исчезает фиолетовая окраска перманганата калия, а во второй наблюдается выпадение осадка (какого?).
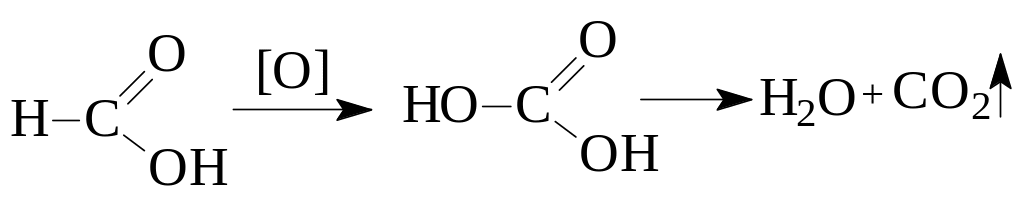
Уксусная, пропионовая, масляная кислоты. устойчивы к действию окислителей, представляют собой бесцветные хорошо растворимые в воде жидкости, идентифицируются по физическим константам.
Трихлоруксусная кислота бесцветная жидкость, хорошо растворимая в воде, по кислотности сравнима с соляной кислотой, поэтому ее водный раствор имеет низкие значения рН в отличие от уксусной и других карбоновых кислот. Наличие хлора доказывают с помощью пробы Бейльштейна (опыт 1.3).
Щавелевая и малоновая кислоты. Представляют собой белые кристаллические вещества, растворимые в воде, по кислотности значительно сильнее уксусной кислоты. Идентифицируют их по отношению к нагреванию:
НООССООН СО2 + НСООН Н2О + СО
НООССН2СООН СО2+ СН3СООН
СО2+ Ba(OH)2 ВаСО3 + Н2О
Примерно 1 г кристаллов кислоты помещают в пробирку с газоотводной трубкой, конец которой опущен в другую пробирку с 13 мл баритовой воды (34). Первую пробирку нагревают, выделение углекислого газа обнаруживают по выпадению осадка (какого?). Трубку вынимают из жидкости и у ее отверстия пробуют поджечь выделяющийся газ. Если наряду с диоксидом углерода выделяется СО, то наблюдается характерное голубое пламя, в противном случае газ не горит.
Винная (d,l) кислота. Представляет собой белое кристаллическое вещество, растворимое в воде, содержит наряду с карбоксильными группами вицинальную диольную группировку, поэтому дает положительную пробу с гидрокисдом меди (II) на гликоли (опыт 2.4.1).
Бензойная и фталевая кислоты. Представляют собой белые кристаллические вещества, мало растворимые в воде, являются ароматическими, что можно обнаружить пробой на свечение пламени по большому количеству копоти (см. опыт 1.3). Различить их можно по отношению к нагреванию. В сухую пробирку помещают 0,2 г кислоты и нагревают над пламенем горелки, держа пробирку горизонтально. Обе кислоты при нагревании возгоняются, а в холодной зоне пробирки наблюдается появление белых кристаллов. При этом бензойная кислота не разлагается, а фталевая кислота легко теряет воду с образованием фталевого ангидрида, который можно отличить от кислоты по хорошей растворимости в толуоле (14).
Коричная кислота идентифицируется путем открытия ароматического кольца (опыт 1.5) и двойной связи (опыты 1.4.1, 1.4.2).
Ацетилсалициловая кислота белое кристаллическое вещество, мало растворимое в воде. Содержит сложноэфирную группировку наряду с СООН, поэтому дает положительную пробу с гидрокарбонатом натрия (опыт 2.1.2) и в реакции омыления с гидроксидом натрия (опыт 2.5). Для подтверждения результата опыт 2.5 повторяют, при этом образуется фенолокислота, в которой фенольный гидроксил открывают с помощью опытов 2.2.
Идентификация фенолокислот. 2-гидроксибензойная (салициловая), 4-гидроксибензойная, 3,4,5-тригидроксибензойная (галловая) кислоты являются фенолокислотами и дают положительные пробы на СООН-группу в опытах 2.1.1, 2.1.2 и на фенольный гидроксил в опытах 2.2.
Эти кислоты идентифицируют по физическим константам, кроме того галловую кислоту открывают по способности легко окисляеться кислородом воздуха, особенно в щелочной среде:
В пробирке растворяют 0,1 г вещества в 1 мл 5%-ного NaOH (6) и полученный раствор оставляют стоять. При наличии галловой кислоты окраска постепенно изменяется, начиная с верхнего слоя.
2. Идентификация фенолов возможна с помощью качественных реакций с бромной водой (опыт 2.2.2) и хлоридом железа (III) (опыт 2.2.1). Результаты опытов сравнивают с данными табл. 2. 8.
