- •Прохождение тока в электрохимических системах. Законы фарадея
- •Лабораторная работа №2 электровесовой метод анализа
- •Лабораторная работа №3 кулонометрический метод анализа
- •2. Электрическая проводимость растворов электролитов
- •2.1. Методы измерения электрической проводимости
- •Лабораторная работа №4 измерение проводимости растворов электролитов различной концентрации
- •Лабораторная работа №5 определение температурного коэффициента электропроводности электролитов
- •Лабораторная работа № 6 определение растворимости и произведения растворимости труднорастворимой соли
- •Лабораторная работа № 7 определение константы дисоциации слабого электролита
- •Лабораторная работа № 8
- •3. Числа переноса ионов и методы их определения
- •Лабораторная работа №9 определение чисел переноса методом гитторфа
- •5. Электрохимические системы в равновесном состояни
- •Лабораторная работа № 10
- •Лабораторная работа № 11 измерение температурного коэффициента эдс гальванического элемента и расчет термодиинамических величин
- •1. Общие положения
- •2. Порядок выполнения работы
- •Лабораторная работа №12 определение константы нестойкости комплексных ионов меди
- •Лабораторная работа №13 определение стандартной эдс цепи без переноса
- •Лабораторная работа №14 определение растворимости и произведения растворимости труднорастворимых соединений методом измерения эдс
- •Общие указания по составлению отчетов к лабораторным работам
Прохождение тока в электрохимических системах. Законы фарадея
Прохождение электрического тока через проводники первого или второго рода не приводит к химическим превращениям веществ. Количественные превращения протекают только на границах раздела фаз, причем только на тех границах, где один тип электрической проводимости заменяется другим. Количество веществ, прореагировавших на таких границах раздела, зависит от количества присоединенных или выделившихся электронов. Поскольку количество перешедших через границу раздела фаз электронов определяет количество протекшего электричества, то может быть сформулирован первый закон Фарадея, который гласит:
– если на границе раздела проводник первого рода – проводник второго рода при прохождении постоянного электрического тока протекает одна и только одна электрохимическая реакция, то масса каждого из участников реакции, претерпевших превращение, прямо пропорциональна количеству протекшего электричества.
В математическом виде закон Фарадея может быть представлен:
mi = qiIt = qiQ, (1.1)
где mi – масса электрохимически превращенного вещества, г; I – сила тока, А; t – время пропускания тока, с; Q – количество протекшего электричества, Кл; qi – коэффициент пропорциональности, называемый электрохимическим эквивалентом вещества, претерпевающего электрохимическое превращение.
Электрохимический эквивалент показывает, сколько вещества (по массе или объему), претерпевает превращение при прохождении через границу раздела фаз количества электричества, равного единичному значению. Поскольку количество электричества измеряется в Кл (А·с) или А·ч, то численное значение электрохимического эквивалента может измеряться в г/Кл, в моль/Кл, в г/А·ч, моль/А·ч, дм3/А·ч, м3/Кл.
Расчет численного значения qi, г/Кл, проводят по формуле
![]() ,
(1.2)
,
(1.2)
где νi – стехиометрический коэффициент перед веществом в уравнении электродной полуреакции, моль; M – молярная масса вещества, г/моль; z – количество электронов в уравнении электродной полуреакции, моль электронов; F – постоянная (константа) Фарадея, Кл/моль электронов (Кл/моль е).
Для
газообразных продуктов электролиза
объемный электрохимический эквивалент
![]() ,
дм3/Кл,
может быть
рассчитан
,
дм3/Кл,
может быть
рассчитан
![]() ,
(1.3)
,
(1.3)
где
![]() – нормальный молярный объем,
= 22,4 дм3/моль.
– нормальный молярный объем,
= 22,4 дм3/моль.
Постоянная Фарадея имеет одно и тоже значение для всех реакций и определяет количество электричества, которое переносит (содержит) один моль эквивалентов элементарных заряженных частиц. Численное значение постоянной Фарадея определяется как
F = eNА = 1,6 ∙ 10–196,023 ∙ 10–23 ≈ 96 500 Кл/моль, (1.4)
где e – заряд электрона, Кл; NА – число Авогадро, моль-1.
В одном моле вещества содержится NА = 6,023 · 1023 молекул или ионов. Если каждая молекула или ион в электрохимической реакции вступает во взаимодействие с z электронами, то превращение одного моля вещества потребует затраты или будет связано с высвобождением Fм = eNАz количества электричества. Соответственно, один моль электронов вызовет превращение вещества в количестве, эквивалентном одному молю электронов, и это эквивалентное количество составит Fм / z = eNАz / z = eNА.
Связь между природой и количеством прореагировавшего вещества отражает второй закон Фарадея:
– если на границе раздела проводник первого рода – проводник второго рода при прохождении постоянного электрического тока протекает одна и только одна электрохимическая реакция, в которой участвует несколько веществ, то массы участников реакции, претерпевших превращение, относятся друг к другу как их химические эквиваленты Э, т.е. число эквиавлентов взаимодействующих веществ постоянно:
 .
(1.5)
.
(1.5)
Второй закон Фарадея распространяется на любое число границ раздела при условии, если через них пропущено одинаковое количество электричества. Для доказательства примем, что через границу раздела фаз пропущено количество электричества, равное одному фарадею (1F) и тогда из первого закона
∆mi = qi.
Поскольку в соответствии с (1.2)
то при условии, что Fм = F = 1, в предыдущем соотношении
![]() ,
,
и тогда
∆mi = qi = Эi.
Если объединить оба закона Фарадея в виде одного общего закона, то придем к выводу:
– количество электричества, равное одному фарадею (1F = 96500 Кл или 1F = 26,8 А·ч) всегда изменяет электрохимически 1 моль экв вещества независимо от его природы.
Законы Фарадея применимы не только к электролизу водных растворов при обычной температуре, но и к расплавленным средам, они выполняются также при электролитическом разложении твердых солей, обладающих ионной проводимостью.
Процессы, которые подчиняются приведенным выше количественным соотношениям, называются фарадеевскими.
В качестве фарадеевских процессов можно рассматривать реакции окисления (ионизации, растворения) металлов, например,
Fе = Fе2+ + 2e, (1.1)
и реакции восстановления окислителей, входящих в состав раствора, например,
2Н3О+ + 2е = Н2 + Н2О. (1.2)
Первая реакция – пример одного из многочисленных анодных процессов, т.е. процессов, протекающих с передачей электронов проводнику первого рода, например:
2Сr + 7Н2О = Сr2O72– + 14Н+ + 12е, (1.3)
2Н2O = О2 +4Н+ + 4e, (1.4)
2С1– = Сl2 + 2е, (1.5)
Сu+ = Сu2+ + e, (1.6)
а вторая – пример катодных процессов:
O2 + 2Н2О + 4e = 4OН– (1.7)
NО3– + 3Н+ + 2е = НNO2 + Н2О (1.8)
Ni2+ + 2e = Ni, (1.9)
в которых частицы получают электроны от проводника первого рода.
Законы Фарадея, особенно в сочетании с уравнениями материального баланса вещества в реакциях, широко применяются в практике электрохимических исследований, поскольку:
1. Экспериментальное подтверждение законов Фарадея и, соответственно, соблюдение материального баланса по веществу, участвующему в электродном процессе, доказывает правильность выбранного механизма реакции.
2. Если на опыте наблюдаются кажущиеся отклонения от законов Фарадея, то изучение этих отклонений может дать ценную информацию о процессах на электроде в изучаемых условиях. Это связано с тем, что подобные отклонения обычно обусловлены одной из следующих важных причин:
а) на электроде, наряду с изучаемой, протекает параллельно и другая электрохимическая реакция или одновременно несколько параллельных электродных реакций. В таких условиях лишь часть от пропущенного электричества расходуется на протекание основной реакции. Например, при катодном осаждении никеля из кислых электролитов никелирования вместе с реакцией разряда ионов никеля по реакции (1.9) может протекать и реакция выделения водорода по схеме (1.2), а при анодном растворении никеля одновременно может выделяется хлор по схеме (1.5) или кислород по реакции (1.4). Каждая подобная реакция подчиняется закону Фарадея. Но если предполагалось протекание только одной реакции, а количество прореагировавшего вещества (или продукта реакции) оказывается меньше чем рассчитанное по закону Фарадея, то появляется возможность высказать предположение о протекании в условиях опыта еще одного электродного процесса и изучить его особенности.
б) кажущиеся нарушения баланса вещества и законов Фарадея могут быть связаны и с протеканием на электроде процесса, не являющего электрохимическим и не подчиняющимся закону Фарадея. Так, при растворении титана в среде органического растворителя (в метанольных растворах НСl) вместе с фарадеевской реакцией ионизации (растворения) титана
Тi = Ti3+ + 3е (1.10)
протекает и процесс дезинтеграции электрода – разрушения его поверхности за счет выпадения покрытых защитной гидридной пленкой зерен металла, практически не растворяющихся в кислоте. При наличии такого побочного процесса количество перешедших в раствор ионов титана в соответствии с реакцией (1.10) будет точно соответствовать закону Фарадея, однако оно значительно меньше, чем убыль массы электрода, лишь частично связанная с электрохимическим (фарадеевским) растворением титана.
в) третья причина кажущихся отклонений от закона Фарадея заключается в том, что часть образующихся промежуточных продуктов изучаемого электрохимического процесса выводится из зоны реакции в связи с тем или иным «побочным» процессом. Поэтому в изучаемой реакции до конца реагирует лишь часть вступившего в нее вещества.
Наиболее хорошо известный пример такой ситуации – это выделение водорода на катодно-поляризуемом железе, титане, вольфраме в кислых растворах. На поляризуемой поверхности катода молекулярного водорода может выделяться значительно – на десятки процентов меньше, чем следует из закона Фарадея: часть атомов Надс – промежуточных продуктов реакции 2Н3О+ +2е = Н2 + Н2О – не образует молекул Н2, а диффундирует в металл. Другие случаи подобных отклонений были обнаружены при изучении процессов ионизации некоторых металлов. Так, процесс ионизации индия
In =In 3+ + 3e (1.11)
включает две стадии
In = In+ + е, (1.12)
In+ = In3+ + 2е (1.13)
В достаточно кислых растворах значительная часть ионов In+ успевает окисляться до In3+ по реакции
In+ + 2Н+ = In3+ + Н2 (1.14)
раньше, чем по реакции (1.13). Так как в реакции (1.14) электроны металла не участвуют, то фактически на образование ионов In3+ расходуется меньшее количество электричества, чем требует закон Фарадея.
При электролизе растворов хлорида натрия наряду с реакцией (1.5) возможны протекание параллельной электрохимической реакции образования кислорода (реакция 1.4) и побочные химические превращения в объеме раствора, в частности по схеме
Cl2 + H2O = HCl + HClO (1.15)
г) существуют электрохимические системы, которые обладает смешанной ионно-электронной проводимостью (раствор металлического калия в жидком аммиаке). В таких системах возможен переход электронов из раствора на электрод без химического превращения. Аналогичные явления могут наблюдаться при прохождении тока через газы. Химические превращения веществ не будет фиксироваться и в том случае, если через электрохимическую систему пропускать переменный ток.
Чтобы учитывать влияние параллельных электрохимических и побочных химических реакций, введено понятие выхода по току (катодного и анодного). Выход по току определяет ту часть протекшего электричества, которая приходится на долю данной электродной реакции:
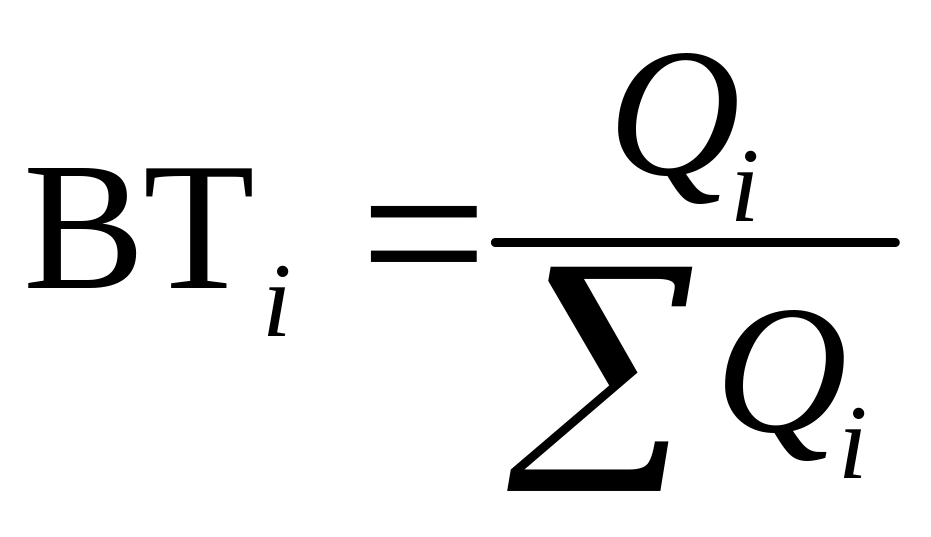 (1.6)
(1.6)
Выход по току также можно определить как отношение величин:
 (1.7)
(1.7)
где Qтеор – количество электричества, необходимое для получения продукта электродной реакции исходя из закона Фарадея, Кл; Qпр – фактические затраты электричества на получение такого же количества вещества, Кл.
При расчете выхода по току можно оперировать и массами веществ, которые получены реально (mпр) и должны были бы быть получены исходя из закона Фарадея (mтеор):
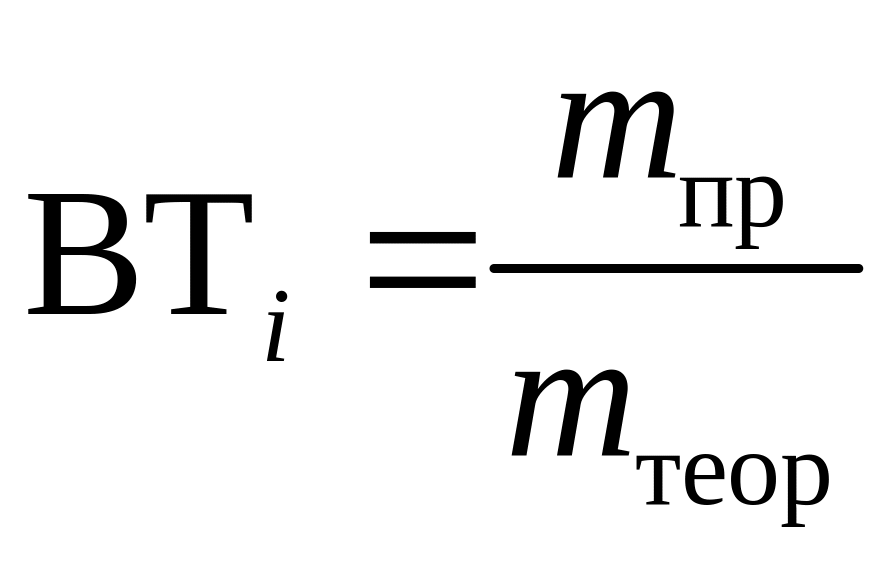 (1.8)
(1.8)
(сравнение масс получаемых веществ должно происходить при одинаковом количестве пропущенного электричества).
Соответственно, если на электроде протекает только одна электрохимическая реакция, то выход по току для каждого из участвующих в ней веществ равен единице или 100%.
Электрохимические системы, в которых не протекают параллельные электрохимические и побочные химические реакции, называют кулонометрами. Основное их назначение – определение количества протекшего электричества. В ходе работы кулонометры всегда включаются в электрическую цепь последовательно. Наиболее часто применяют электрогравиметрические (весовые), газовые (объемные) и титрационные кулонометры [*****]. Кроме того, широкое применение находят также в последнее время электронные кулонометрические интеграторы[****]
Лабораторная работа №1
ОПРЕДЕЛЕНИЕ ВЫХОДА ПО ТОКУ И УДЕЛЬНОГО
РАСХОДА ЭЛЕКТРОЭНЕРГИИ ПРИ КАТОДНОМ
ВОССТАНОВЛЕНИИ МЕТАЛЛОВ
Цель работы – определение выхода по току, удельного расхода электроэнергии на единицу продукции при катодном осаждении металлов в зависимости от условий электролиза.
Первый вариант. Определение выхода по току при электроосаждении никеля в зависимости от кислотности электролита.
Электролит содержит, г/дм3: 125 – сульфата никеля (в пересчете на безводный); 2 (в первом опыте) и 16 (во втором) серной кислоты; 5 – хлорида натрия; 20 – борной кислоты.
Опыты проводят при плотности тока 2 А/дм2, температуре 50–55° С ориентировочно в течение 1–1,5 ч. Время пропускания тока следует уточнить перед началом опыта исходя из законов Фарадея в расчете на осаждение на поверхности электрода покрытия массой около 0,1 г. Катод – никелевый, стальной или медный, аноды – никелевые. Использованный электролит периодически корректируют по результатам анализа на содержание в растворе сульфата никеля и серной кислоты.
Второй вариант. Определение выхода по току цинка в зависимости от присутствия в электролите примесных ионов и добавок поверхностно активных веществ.
Электролит содержит компоненты, г/дм3: 145 сернокислого цинка (в пересчете на безводный); 100 серной кислоты. Катод – алюминиевый, аноды – цинковые. Электролиз производят при непрерывном перемешивании электролита.
Проводят три опыта: первый – с чистым электролитом, второй – с добавкой 15 мг/дм3 Ni2+ и третий – с добавкой 15 мг/дм3 Ni2+ и 25 мг/дм3 блескообразующих добавок, применяемых при гальваническом осаждении цинка (по указанию преподавателя). Опыты ведут при плотности тока 4А/дм2 в течение 0,5–1,0 ч при температуре 40 ± 2°С.
Величину тока во всех опытах рассчитывают исходя из принятой плотности тока и размеров катода по уравнению (при условии двусторонней работы катода)
I = 2Siк· (1.9)
где iк – задаваемая плотность тока, А/дм 2; S – поверхность катода, погружаемая в электролит, дм2.
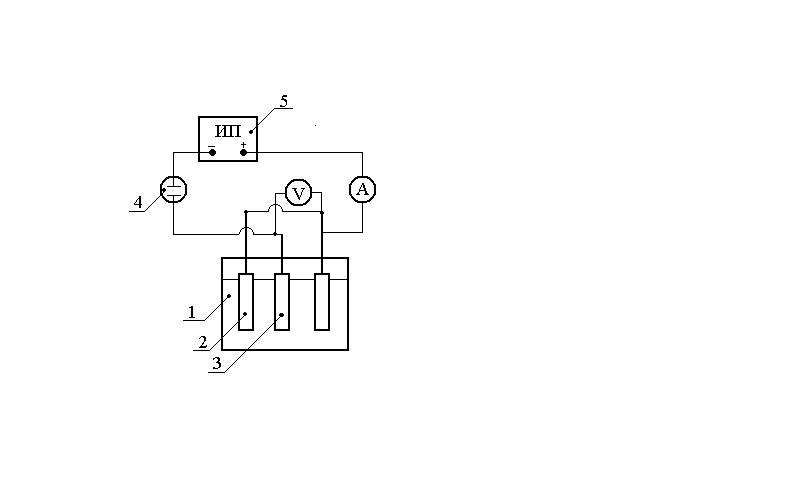
|
Рис. 1. Схема установки для определения выхода по току и удельного расхода электроэнергии: 1 – электролизер; 2 – анод; 3 – катод; 4 – кулонометр; 5 – источник питания постоянного тока |
По окончании электролиза катоды отмывают от электролита, остатки воды удаляют фильтровальной бумагой, электроды просушивают и взвешивают. Выходы по току определяют по привесу катодов электролизера. Количество пропущенного электричества определяют как произведение силы тока на время его пропускания. В некоторых опытах по указанию преподавателя количество протекшего электричества может быть определено с помощью кулонометра.
Выход по току оценивают из соотношения:
 (1.10)
(1.10)
где ∆mэксп – изменение массы катода в ходе опыта, г; qi – электрохимический эквивалент осаждаемого металла, г/А ч.
Расход электроэнергии на единицу продукции (Wуд) определяют по уравнению
 (1.11)
(1.11)
где U – измеренное напряжение на электролизере, В.
В конце работы делается вывод о влиянии кислотности раствора (в первом варианте), содержания посторонних ионов, присутствия поверхностно-активных веществ (во втором) на выход по току и удельный расход электроэнергии.