
- •Прохождение тока в электрохимических системах. Законы фарадея
- •Лабораторная работа №2 электровесовой метод анализа
- •Лабораторная работа №3 кулонометрический метод анализа
- •2. Электрическая проводимость растворов электролитов
- •2.1. Методы измерения электрической проводимости
- •Лабораторная работа №4 измерение проводимости растворов электролитов различной концентрации
- •Лабораторная работа №5 определение температурного коэффициента электропроводности электролитов
- •Лабораторная работа № 6 определение растворимости и произведения растворимости труднорастворимой соли
- •Лабораторная работа № 7 определение константы дисоциации слабого электролита
- •Лабораторная работа № 8
- •3. Числа переноса ионов и методы их определения
- •Лабораторная работа №9 определение чисел переноса методом гитторфа
- •5. Электрохимические системы в равновесном состояни
- •Лабораторная работа № 10
- •Лабораторная работа № 11 измерение температурного коэффициента эдс гальванического элемента и расчет термодиинамических величин
- •1. Общие положения
- •2. Порядок выполнения работы
- •Лабораторная работа №12 определение константы нестойкости комплексных ионов меди
- •Лабораторная работа №13 определение стандартной эдс цепи без переноса
- •Лабораторная работа №14 определение растворимости и произведения растворимости труднорастворимых соединений методом измерения эдс
- •Общие указания по составлению отчетов к лабораторным работам
Лабораторная работа №12 определение константы нестойкости комплексных ионов меди
Цель работы. Определении константы нестойкости комплексного иона оксалата меди Сu(С2О4)22–.
Оборудование: высокоомный вольтметр или иономер типа И-130, И-150; термостат; стеклянные сосуды; реактивы, электроды.
Общие положения.
Для определения константы нестойкости комплексного соединения (например, Сu(С2О4)22- или Сu(Р2O7)26-) измеряют ЭДС одного из элементов:
![]()
или
![]()
ЭДС первого элемента при 25° С равна
Е
= 0,344
+ 0,02989 lg![]() – 0,2438; (5.23)
– 0,2438; (5.23)
второго
Е = 0,344 + 0,02989 lg – 0,2, (5.24)
где 0,344 — стандартный потенциал медного электрода, В; 0,2438 – потенциал насыщенного каломельного электрода при 25°С; 0,2 – потенциал насыщенного хлоридсеребряного электрода при 25°С; – активность ионов меди в растворе, содержащем исследуемый комплекс.
Константу нестойкости комплекса иона определяют по уравнению
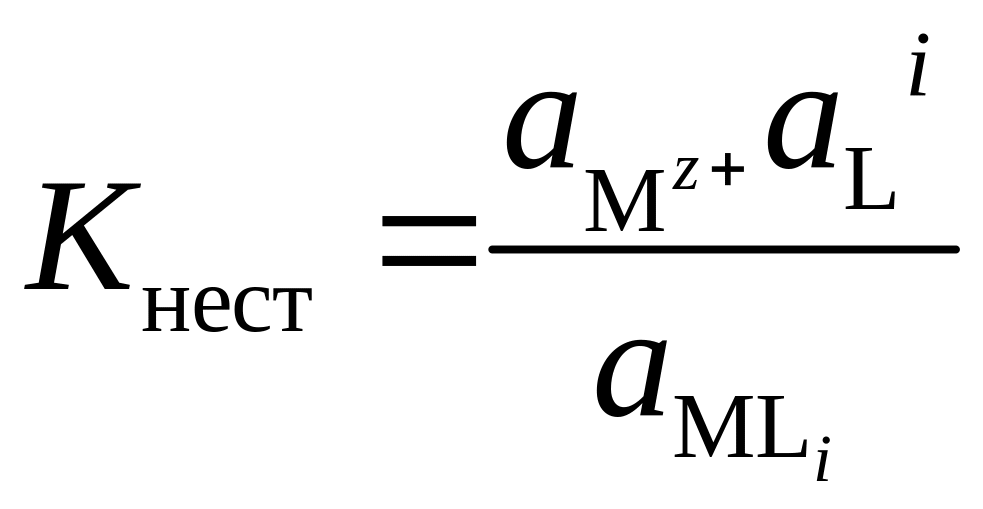 (5.25)
(5.25)
Если перейти от активностей к соответствующим концентрациям, то
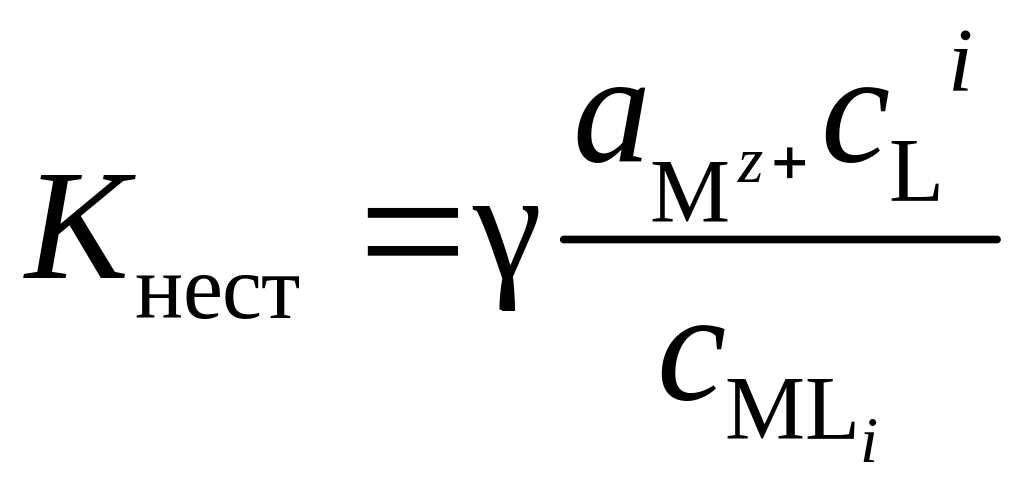 (5.26)
(5.26)
где
![]() — концентрация
комплексных ионов, сL
– концентрация
свободных лигандов.
— концентрация
комплексных ионов, сL
– концентрация
свободных лигандов.
Для
растворов, содержащих оксалатные
комплексы меди, можно считать, что
концентрация комплексных ионов
равна начальной концентрации меди
![]() ,
содержащейся в растворе. Концентрацию
свободных лигандов сL
можно
определить, вычитая из общей концентрации
оксалата удвоенное значение концентрации
комплекса, т. е. удвоенное значение
начальной концентрации ионов меди в
растворе.
,
содержащейся в растворе. Концентрацию
свободных лигандов сL
можно
определить, вычитая из общей концентрации
оксалата удвоенное значение концентрации
комплекса, т. е. удвоенное значение
начальной концентрации ионов меди в
растворе.
Величина γ определяется коэффициентами активности комплексного иона меди и лиганда:
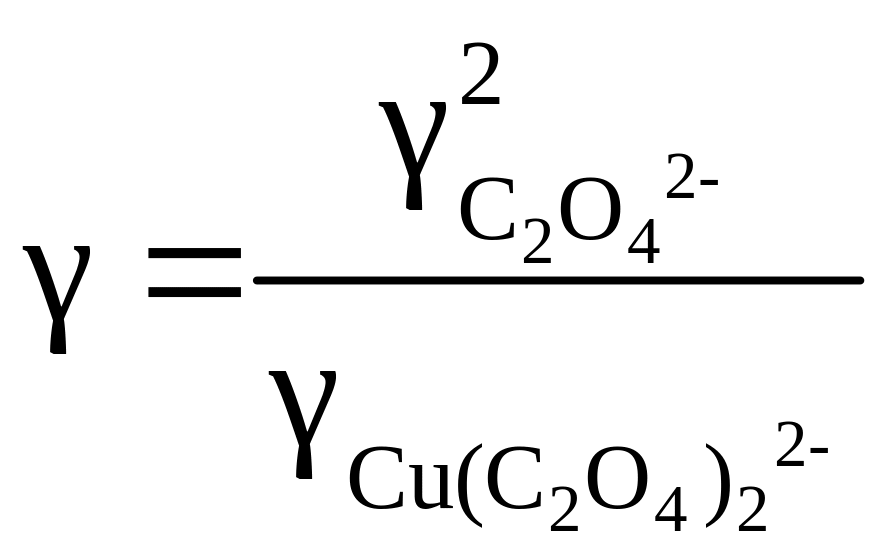 .
(5.27)
.
(5.27)
Коэффициенты активности в зависимости от заряда иона zi и ионной силы раствора I при 20оС приведены в таблице.
zi |
Коэффициент активности γi в зависимости от ионной силы раствора |
||||
0,005 |
0,010 |
0,030 |
0,050 |
0,100 |
|
1 |
0,95 |
0,93 |
0,87 |
0,85 |
0,80 |
2 |
0,80 |
0,74 |
0,63 |
0,56 |
0,46 |
3 |
0,62 |
0,52 |
0,35 |
0,28 |
0,20 |
4 |
0,43 |
0,32 |
0,19 |
0,11 |
0,06 |
5 |
0,34 |
0,21 |
0,11 |
0,07 |
0,05 |
6 |
0,21 |
0,13 |
0,07 |
0,05 |
0,04 |
За 1 принята активность ионов при бесконечном разведении |
|||||
Чтобы убедиться в правильности получаемых результатов, следует измерять ЭДС цепей при различных концентрациях свободных ионов в растворе. При этом вычисленные по уравнению (5.25) значения константы нестойкости не должны изменяться. Приближенная оценка коэффициентов активности может быть произведена с помощью данных таблицы.
Чаще используют растворы, для которых ионная сила
![]() ,
(5.28)
,
(5.28)
и, следовательно, коэффициенты активности постоянны. Постоянство ионной силы обеспечивается введением в исследуемый раствор посторонней нейтральной соли. Постоянство ионной силы раствора обеспечивает постоянство диффузионных потенциалов, которые, таким образом, вносят одинаковую ошибку в измерения.
Ход выполнения работы.
Особенность проводимого экспериментального исследования – необходимость особо тщательного приготовления растворов для измерений. Общая концентрация металла в этих растворах не должна быть высокой, так как иначе коэффициенты активности не могут быть оценены достаточно точно. Следует выбирать концентраций растворов таким образом, чтобы их ионная сила не превышала 0,1. После этого приготовляют концентрированные растворы необходимых солей, например 0,1 моль/дм3 СuSО4, 0,1 моль/ дм3 Nа2С2О4, 0,1 моль/ дм3 Nа2SО4. Обозначим исходные растворы соответственно 1, 2, 3.
Концентрацию исходного раствора сульфата меди устанавливают комплексонометрическим титрованием трилоном Б с индикатором мурексидом в среде аммиачного буфера.
Затем исходные растворы смешивают таким образом, чтобы получить необходимую концентрацию. Например, чтобы получить 30 см3 раствора, содержащего, моль/дм3: 0,005 CuSO4, 0,15 Nа2С2О4, 0,015 Nа2SО4, нужно взять 2,5 см3 раствора 1 и 7,5 см3 раствора 2, добавить к ним 7,5 см3 раствора 3, смешать их в мерной колбе на 50 cм3, куда затем добавить дистиллированную воду до метки. Ионную силу полученного раствора определяют следующим образом. Учитывая, что концентрацией Сu2+ ионов в таком растворе можно пренебречь, легко подсчитать, что раствор будет содержать, моль/дм3: 0,005 Nа2[Сu(C2O4)2] + 0,005 Nа2С2О4 + 0,020 Nа2SО4.
Отсюда ионная сила равна
I = 1/2(0,005·4 + 0,005 2 + 0,005 4 + 0,005 2 + 0,002 2 + 0,002 4) = 0,09.
При такой ионной силе коэффициент активности двухвалентных ионов можно считать примерно равным 0,46. Поэтому коэффициент в уравнении (5.26) γ = 0,46. Определив аСu2+ по потенциалу медного электрода в изучаемом растворе, подсчитывают Кнест.
