
- •Лекція 5
- •5.1. Основні означення
- •5.2. Закон гесса
- •5.3.Розрахунок теплових ефектів
- •5.3.1. Розрахунок теплових ефектів хемічних реакцій за теплом утворення сполук
- •Наприклад, отримання при 25 ºС Al2(sо4)3 з кристалічного Аl2о3 (т) і ґазу sо3 за реакцією:
- •5.3.2. Тепловий ефект утворення сполуки певного аґреґатного стану (тепло аґреґатного стану)
- •5.3.3. Тепловий ефект утворення сполуки у розчині (тепло розчинення)
- •5.3.4. Тепло розведення розчину
- •5.3.5. Тепло взаємодії кислоти та основи
- •5.3.6. Розрахунок теплового ефекту хемічних реакцій за теплом згоряння
- •Лекція 6
- •6.1.Означення другого начала термодинаміки
- •6.2. Рівняння другого начала термодинаміки
- •6.3. Коефіцієнти ефективности термодинамічних циклів
- •6.3.1.Прямий цикл
- •6.3.2. Зворотній цикл
- •6.4. Цикл карно
- •6.4.1. Прямий цикл Карно
- •6.4.2. Зворотній цикл Карно
- •6.5. Математичні вирази другого начала термодинаміки
- •Термодинамічний процес (незамкнутий цикл)
- •7.1.Означення характеристичних функцій і термодинамічних потенціалів
- •7.2. Ентропія, внутрішня енергія і ентальпія як характеристичні функції
- •7.3. Ізохорно-ізотермний потенціал гельмгольца
- •7.4. Ізобарно-ізотермний потенціал ґіббса
- •7.5.Десять вислідів з попередньої частини лекції
- •7.6. Рівняння гельмгольца
- •7.7. Рівняння ґіббса
- •7.8.Рівняння ґіббса-гельмгольца
- •Лекція 8
- •8.1. Залежність характеристичних функцій та ентропії від тиску. Фуґітивність
- •Стандартний стан
- •8.2. Хемічний потенціал
- •8.3.Хемічний потенціал ідеального ґазу
- •8.4.Хемічний потенціал реального ґазу
- •Лекція 9
- •9.1. Активність реальних ґазів і розчинів
- •9.1.1. Активність реального ґазу
- •9.1.2. Активність компонентів розчину
- •9.2. Хемічна рівновага
- •9.2.2. Рівняння рівноваги для суміші ідеальних ґазів і константа рівноваги
- •9.2.3. Рівняння рівноваги для ідеального розчину і константа рівноваги
- •9.2.4.Рівняння рівноваги для суміші реальних ґазів і константа рівноваги
- •9.2.5. Рівняння рівноваги для неідеальних розчинів і константа рівноваги
- •9.2.6. Закон діяння мас Ґульдберґа-Воґе
- •9.3.Рівняння ізотерми і напрямок хемічної реакції
- •Для ідеального розчину
- •Для суміші реальних ґазів
- •9.4.Стандартний потенціал ґіббса хемічної реакції Введемо поняття стандартного потенціалу Ґіббса і знайдемо його зв’язок з константами рівноваги хемічної реакції:
- •Для суміші ідеальних ґазів
- •Для ідеального розчину
- •Для неідеального розчину
- •9.5. Константа рівноваги і стандартний потенціал ґіббса хемічної реакції
- •9.6.Константа рівноваги і способи вираження складу реакційної суміші
- •9.7.Вплив тиску на рівновагу хемічної реакції. Принцип зміщення рівноваги ле шательє-брауна
- •Приклади
- •Гетерогенна хемічна рівновага
- •9.9.Залежність константи рівноваги від температури. Рівняння ізобари та ізохори хемічної реакції
- •Рекомендована література
- •Використані джерела інформації
5.3.4. Тепло розведення розчину
1. Додавання розчинника до розчину також супроводжується тепловим ефектом − теплом розведення.
2. Чим більше розведений розчин, тим тепло розведення менше.
3. Тепло розведення розраховують за інтеґральним теплом розчинення.
4. Розрізняють інтеґральне і проміжне тепло розведення (рис. 5.4):
Інтеґральне
тепло розведення
![]() − тепловий ефект, який спостерігається
при розведенні розчину, який містить 1
моль розчиненої речовини, до безкінечного
(∞) розведення (m=0):
− тепловий ефект, який спостерігається
при розведенні розчину, який містить 1
моль розчиненої речовини, до безкінечного
(∞) розведення (m=0):
![]() −
−![]() =
=![]() (рис.5.4),
(5.45)
(рис.5.4),
(5.45)
де
![]() (рис.5.4)
− інтеґральне тепло розчинення 1 моля
речовини у ∞ кількости розчинника (d
– від dilution
– розведений, diluted
– розбавлений );
(рис.5.4)
− інтеґральне тепло розчинення 1 моля
речовини у ∞ кількости розчинника (d
– від dilution
– розведений, diluted
– розбавлений );
![]() − інтеґральне
тепло розчинення 1 моля речовини при
m1-концентрації
розчину.
− інтеґральне
тепло розчинення 1 моля речовини при
m1-концентрації
розчину.
·
Проміжне
тепло розведення
![]() (рис.5.4)
− тепловий ефект, який спостерігається
при розведенні розчину, який містить
1 моль розчиненої речовини, від
концентрації m2
до m1
(m2
> m1)
і дорівнює різниці інтеґральних теплот
розчинення:
(рис.5.4)
− тепловий ефект, який спостерігається
при розведенні розчину, який містить
1 моль розчиненої речовини, від
концентрації m2
до m1
(m2
> m1)
і дорівнює різниці інтеґральних теплот
розчинення:
![]() (рис.5.4).
(5.46)
(рис.5.4).
(5.46)
· Проміжним теплом розчинення називають тепловий ефект, який отримують при концентруванні розчину від m1 до m2 (m1<m2 ):
![]() (рис.5.4).
(5.47)
(рис.5.4).
(5.47)
5.3.5. Тепло взаємодії кислоти та основи
1. При взаємодії моль-еквівалентів сильної кислоти з сильною основою в розбавлених водних розчинах виділяється майже однакова кількість тепла:
![]() (n
– від neutralization
– нейтралізація).
(n
– від neutralization
– нейтралізація).
Сталість кількостей тепла нейтралізації пов’язана з тим, що при взаємодії сильних кислот з сильними основами, які повністю дисоційовані у розбавлених водних розчинах, з іонів Н+ (вірніше іонів гідроксонію Н3О+) кислоти та іонів ОН− основи утворюється молекула Н2О (р):
H+ + Cl− + K+ + OH− = K+ + Cl− + H2O (p), (5.48)
![]()
![]() −
тепло
утворення Н2О
з іонів.
−
тепло
утворення Н2О
з іонів.
2. При нейтралізації слабких кислот сильними основами або слабких основ сильними кислотами, що супроводжується дисоціацією слабкого електроліту, тепло дисоціації ∆Ндис виділяється (знак «−») або поглинається (знак «+»).
Тепло дисоціації залежить від тепла, що поглинається при розпаді молекули на йони (знак «+»), і тепла гідратації йонів молекулами розчинника (знак «−»), що виділяється.
Таким чином, тепло дисоціації залежить може мати знак «+» або «−», а тепло нейтралізації:
а) слабких кислот сильними основами складається з тепла утворення води з йонів плюс тепло дисоціації слабкого електроліту (кислоти):
![]() кДж/моль;
(5.49)
кДж/моль;
(5.49)
б) слабких основ сильними кислотами складається з тепла утворення води з йонів плюс тепло дисоціації слабкого електроліту (основи):
![]() кДж/моль.
(5.50)
кДж/моль.
(5.50)
3. При точних розрахунках тепла нейтралізації необхідно враховувати два проміжних тепла розбавлення (розведення), так як при змішуванні розчинів кислоти та основи відбувається зміна об’ємів як кислоти, так і основи.
5.3.6. Розрахунок теплового ефекту хемічних реакцій за теплом згоряння
Теплом згоряння називають тепловий ефект реакцій окиснення 1 моля даної сполуки при p=const киснем до вищих оксидів відповідних елементів або сполук цих оксидів.
Для органічних сполук теплом згоряння називають тепловий ефект хемічної реакції повного згоряння даної сполуки і утворення з елементів С, Н, N, S, Cl тощо СО2 (ґ), Н2О (р), N2 (ґ), SO2 (ґ), HCl (ґ) та інших відповідних сполук.
Тепло згоряння таких кінцевих продуктів часто приймають за такі, що дорівнюють нулю.
Тепло згоряння сполук, що знайдені експериментально, приводять до стандартних умов (t=25ºС; рº=0,101325 МПа=1атм).
Тепло згоряння палива характеризує його теплотворну здатність.
Якщо відоме тепло згоряння всіх речовин, що беруть участь у хемічній реакції, то за ними можна розрахувати тепловий ефект самої реакції.
Із закону Гесса витікає, що тепловий ефект хемічної реакції дорівнює різниці між сумою тепла згоряння вихідних речовин і сумою тепла згоряння кінцевих продуктів реакції з урахуванням стехіометричних коефіцієнтів рівняння реакції:
![]() (5.51)
(5.51)
Так, для хемічної реакції
![]() (5.52)
(5.52)
тепловий ефект дорівнює:
![]() .
(5.53)
.
(5.53)
Так, стандартне тепло згоряння аніліну (р) є тепловий ефект хемічної реакції при рº=1 атм і t=25ºС:
![]() (ґ)→
(ґ)→![]() (ґ)
(ґ)![]() (ґ)
(ґ)![]() =−3396
=−3396![]() (5.54)
(5.54)
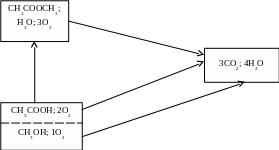
Приклад схеми розрахунків для реакції утворення естеру з кислоти і спирту (рис. 5.5):
СН3СООН + СН3ОН = СН3СООСН3 + Н2О (р) (5.55)
Для Н2О, як кінцевого продукту реакції згоряння, приймають
![]() .
.
Тепловий ефект реакції (5.50):
![]() (5.56)
(5.56)
![]() ,
,
![]() (5.57)
(5.57)
![]()
 ,
,
![]() (5.58)
(5.58)
![]() ,
,
![]() .(5.59)
.(5.59)
Схема процесу приведена на рис. 5.5.
![]()
![]()
![]()
Рис. 5.5. Схема процесу згоряння з утворенням естеру з кислоти і спирту
