
методичка р-элементы
.pdfФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ЗДРАВООХРАНЕНИЮ И СОЦИАЛЬНОМУ РАЗВИТИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
САНКТ−ПЕТЕРБУРГСКАЯ ГОСУДАРСТВЕННАЯ ХИМИКО−ФАРМАЦЕВТИЧЕСКАЯ АКАДЕМИЯ
Кафедра неорганической химии
p-ЭЛЕМЕНТЫ
Учебное пособие
Санкт-Петербург – 2008
2
Вданном пособии по изучению раздела «р-Элементы» систематизированы сведения
охимических свойствах элементов и их биологической роли в живых организмах, способах получения, свойствах и применении соединений.
Сформулированы контрольные вопросы, составлены упражнения и экспериментальные задачи для освоения и закрепления изучаемого материала.
Пособие предназначено для студентов 1 курса факультета промышленной технологии лекарств, а также может быть использовано студентами фармацевтического факультета заочного отделения.
Утверждено методической комиссией ФПТЛ СПХФА протокол № 1 от 5.10.2004.
Рекомендовано УМО по медицинскому и фармацевтическому образованию России в качестве учебного пособия для студентов фармацевтических и медицинских ВУЗов.
Авторы:
канд. хим. наук, доц. Л.И.Иозеп канд. хим. наук, доц. Н.Г.Тихомирова канд. хим. наук, ст. преп. О.В.Сибикина докт. хим. наук, проф. А.В.Москвин
Рецензенты:
Заведующий кафедрой химии СПбГМА им. И.И.Мечникова, профессор, доктор химических наук Слесарев В.И.
Доцент кафедры аналитической химии СПХФА, кандидат химических наук Алексеева Г.М.
© — Санкт-Петербургская государственная химико-фармацевтическая академия, 2008
3
ВВЕДЕНИЕ
Свойства элементов и их соединений определяются строением электронных оболо-
чек атомов и, главным образом, строением внешнего валентного уровня.
В зависимости от заполнения электронных оболочек атомов электронами элементы периодической системы Д. И. Менделеева делят на s-, р-, d- и f-семейства.
К семейству p-элементов относятся элементы главных подгрупп III–VIII групп. В
атомах этих элементов заполняются р-подуровни внешних электронных слоев. Внутрен-
ние электронные слои остаются неизменными.
Изменение свойства р-элементов и их соединений в периоде связано с увеличением числа электронов на внешнем слое от 3 (ns2p1 у р-элементов III группы) до 8 (ns2p6 у р-
элементов VIII группы). При этом усиливается взаимодействие электронов с ядром,
уменьшается радиус атома, увеличиваются энергия ионизации и относительная электро-
отрицательность (ОЭО). Для элементов II периода эти величины приведены ниже:
Свойство |
B |
C |
N |
O |
F |
Ne |
Радиус атома, нм |
0,077 |
0,062 |
0,052 |
0,045 |
0,040 |
0,035 |
Энергия ионизации, эВ |
8,30 |
11,26 |
14,53 |
13,61 |
17,42 |
21,56 |
ОЭО |
2,0 |
2,6 |
3,0 |
3,5 |
3,9 |
— |
Следовательно, с уменьшением радиуса ослабевают восстановительные и металли-
ческие свойства элементов и возрастают окислительные и неметаллические свойства.
Литература
1. Некрасов Б. В. Основы общей химии. СПб–М.–Краснодар: Лань, 2003. Т. 1. С. 34–
62, 238–295, 311–364, 382–478, 492–643; Т. 2. С. 5–71.
2. Ахметов Н. С. Общая и неорганическая химия. М.: Высшая школа, 2001. С. 309–
510, 539–545.
3.Карапетьянц М. X., Дракин С. И. Общая и неорганическая химия: учебное пособие для вузов. М.: Химия, 2000. С. 342–476.
4.Суворов А.В., Никольский А.Б. Общая химия: Учебник для вузов. СПб: Химиздат, 2000. С. 293–450.
4
5. Гольбрайх 3. Е. Сборник задач и упражнений по химии. М.: Выс шая школа, 2004.
С. 302–338.
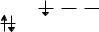
5
1.р-ЭЛЕМЕНТЫ ГРУППЫ III
1.1.ОБЩАЯ ХАРАКТЕРИСТИКА р-ЭЛЕМЕНТОВ III ГРУППЫ
Атомы р-элементов III группы имеют следующие электронные конфигурации:
B 1s22s2p1
Al 1s22s2p63s2p1
Ga 1s22s2p63s2p6d104s2p1
In 1s22s2p63s2p6d104s2p6d105s2p1
Tl 1s22s2p63s2p6d104s2p6d10f145s2p6d106s2p1
Валентными являются электроны внешнего слоя ns2p1
np
ns
На предпоследнем уровне в атоме бора 2 электрона (оболочка гелия), в атоме алю-
миния 8 электронов, а у Gа, In, Тl — 18. Галлий, индий и таллий являются полными элек-
тронными аналогами и их объединяют в подгруппу галлия.
В атомах алюминия и элементов подгруппы галлия в образовании химических связей могут принимать участие и вакантные d-орбитали внешнего уровня.
Исходя из строения атомов и приведенных количественных характеристик (табл. 1.1), можно сделать следующие выводы об общих свойствах р-элементов III группы:
1. Аномально высокие значения энергии ионизации и ОЭО галлия должны свиде-
тельствовать о более слабых металлических свойствах галлия по сравнению с алюминием.
Это объясняется уменьшением радиуса атома галлия вследствие d-сжатия.
Вследствие лантаноидного сжатия радиус атома таллия (у него заполнен 4f-
подуровень) по сравнению с атомом индия увеличивается лишь незначительно и энергия ионизации атома таллия выше.
2. Все элементы, за исключением таллия, проявляют устойчивую степень окисления
III.
В атоме таллия 6s2-электроны являются инертными, так как они проникают под экран из 5d- и 4f-электронов, что усиливает связь этих электронов с ядром. Поэтому для таллия более устойчивой является степень окисления I.
6
Таблица 1.1. Некоторые характеристики элементов главной подгруппы группы III
периодической системы |
|
|
|
|
|
|
Свойства атомов |
B |
Al |
Ga |
In |
Tl |
|
и простых веществ |
||||||
|
|
|
|
|
||
Радиус атома, нм |
0,097 |
0,143 |
0,139 |
0,166 |
0,171 |
|
Потенциал иониэации, эВ |
8,3 |
5,98 |
6,00 |
5,79 |
6,11 |
|
Относительная электроот- |
|
|
|
|
|
|
рицательность |
2,01 |
1,47 |
1,82 |
1,49 |
1,44 |
|
(ОЭО) |
|
|
|
|
|
|
Степени окисления |
–III, III |
III |
III |
I, III |
I, III |
|
Стандартный электродный |
|
|
|
|
|
|
потенциал |
— |
–1,67 |
–0,52 |
–0,34 |
+0,72 |
|
φ°(Э3+|Э), В |
|
|
|
|
|
3. Как элемент II периода, бор очень отличается от других элементов III группы. Он образует только ковалентные соединения, так как ввиду малого радиуса иона В3+ в соеди-
нениях характеризуется сильным поляризующим действием. Катиона В3+ не существует, а
гидроксид проявляет только кислотные свойства. Н3BO3 — слабая кислота. Бор — неме-
талл и в свободном состоянии и в химических соединениях аналогичен кремнию (диаго-
нальная аналогия).
Алюминий, галлий и индий проявляют металлические и неметаллические свойства,
таллий — только металлические.
4. В возбужденном состоянии валентная оболочка атомов p-элементов III группы со-
держит три неспаренных электрона:
np
ns
После образования трех ковалентных связей остается вакантной одна р-орбиталь.
Такие молекулы являются электрононенасыщенными (электронодефицитными) и облада-
ют акцепторными свойствами. Электронодефицитность характерна в большей степени для соединений бора, в меньшей — для алюминия и почти нехарактерна для элементов под-
группы галлия.
5. Образование кратных связей нехарактерно для р-элементов III группы. Исключе-
ние представляют некоторые соединения бора, например, боразол, который по структуре и свойствам сходен с бензолом.
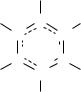
7
H
H B- N+ B- H
H N+ B- 
 N+ H
N+ H
H
1.2.БОР
1.2.1.Нахождение в природе. Способы получения
Вприроде бор встречается в виде борной кислоты Н3BO3 и солей Nа2B4O7·10Н2O, Nа2B4O7·4Н2O, CaB4O7·4Н2O. В морской воде содержится бора 0,2 г/м3. Соединения бора встречаются также в водах горячих природных источников и в продуктах извержения вулканов.
а) «Аморфный» бор — темно-бурый порошок мелкокристаллической структуры, со-
держит значительное количество примесей. Получают его из борной кислоты:
2Н3BO3 = В2O3 + 3Н2O
В2O3 + 3Mg = 3MgO + 2B
б) Кристаллический бор получают термическим разложением галогенидов бора или восстановлением их водородом:
2ВСl3 + 3Н2 = 2B + 6НСl 2ВВr3 = 2B + 3Вr2
Для бора в соединениях характерны sр2- (BF3, Н3BO3) и sр3-гибридизации (Н[BF4],
Н[B(OH)4]) его атомных орбиталей и, следовательно, молекулы боросодержащих соеди-
нений имеют конфигурацию, соответственно, плоского треугольника или тетраэдра. В
случае бора способность к комплексообразованию выражена особенно ярко, вследствие того, что вакантная р-орбиталь атома бора обладает низкой энергией. Типичные примеры таких реакций:
ВF3 + НF = Н[ВF4]
Н3BO3 + Н2O = Н[B(ОН)4]
8
1.2.2. Химические свойства бора
Реакционная способность свободного бора зависит от степени чистоты и степени из-
мельчения, поэтому кристаллический бор более инертен, чем «аморфный». В обычных условиях бор взаимодействует только со фтором, а при очень высоких температурах по-
чти со всеми элементами. При 700 °С бор сгорает красноватым пламенем с образованием оксида:
4В + 3О2 = 2B2O3
Высокое значение энтальпии образования В2O3 (ΔfН°298 = –1461 кДж/моль) объясня-
ет способность бора вытеснять ряд элементов из их оксидов:
10В + 3Р2O5 = 5B2O3 + 6P
4В + 3СO2 = 2B2O3 + 3С 4В + 3SiO2 = 2В2O3 + 3Si
Концентрированная азотная кислота при нагревании медленно растворяет бор:
В+ 3НNO3 = Н3BO3 + 3NO2
Крастворам щелочей бор устойчив, но в присутствии окислителей реагирует с обра-
зованием метаборатов:
2В + 2KОН + 3NaClO = 2KBO2 + 3NaCl + H2O 2B+3Na2O2 сплав. 2NaBO2 +2Na2O
При непосредственном взаимодействии бора с металлами при нагревании образуют-
ся бориды нестехиометрического состава, например, МВ, МВ2, МВ6, М3В4 и другие.
Большинство боридов химически инертно. Например, на борид таллия ТlВ2 не дей-
ствует кипящая «царская водка», хотя аналогичный по составу борид магния МgB2 разла-
гается разбавленными кислотами и даже водой. С углеродом бор образует карбид В4C яв-
ляющийся одним из самых твердых веществ и применяющийся в качестве абразивного материала. Соединение бора с азотом — нитрид бора ВN — получен в двух формах. Одна имеет слоистую структуру подобно графиту («белый графит») и используется как высоко-
температурная смазка. Вторая имеет алмазоподобную структуру (боразон, или эльбор) и
используется в технике как заменитель алмаза.
9
1.2.3. Соединения бора с водородом
Соединения бора с водородом (бороводороды, или бораны, или гидриды бора) полу-
чают косвенно. Например:
6МgB2 + 12НСl = 6МgCl2 + В4H10 + Н2 + 8В
Одновременно выделяются бораны другого состава: В5H9 (пентаборан(9)), В6H10 (гексабо-
ран(10)) и другие. Простейший гидрид бора ВН3 не выделен. В свободном состоянии по-
лучены гидриды бора двух типов BnHn+4 и ВnHn+6. Все они имеют характерный неприят-
ный запах и очень токсичны, вызывают головную боль и психическую депрессию, пора-
жают органы дыхания, почки и печень.
Бораны — жидкие, кроме В2Н6, очень нестойкие и реакционноспособные вещества.
При их сгорании выделяется большое количество энергии.
Наиболее изученным гидридом бора является диборан В2Н6, который получают из тетрагидридобората(1–) натрия или галогенидов бора:
3NaBH4 + 4BF3 = 3NaBF4 + B2H6
2NaBH4 + H2SO4 = B2H6 + 2H2 + Na2SO4 3LiAlH4 + 4BCl3 = 3LiCl + 3AlCl3 + 2B2H6
Диборан легко разлагается водой:
В2H6 + 6Н2O = 6Н2 + 3Н3BO3
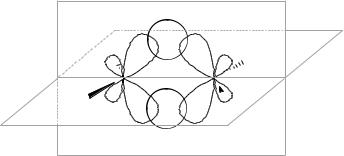
В молекулах боранов электронов меньше, чем это необходимо для образования двухэлектронных связей. Исследование строения молекулы диборана различными физи-
ческими методами показало, что в этом соединении два атома водорода отличаются от остальных четырех.
H |
H |
|
|
H |
|
B |
|
B |
H |
H |
H |
|
|
В молекуле имеются двух- и трехцентровые связи. Каждый атом бора связан с двумя атомами водорода двухцентровыми двухэлектронными связями. Связь между атомами
10
бора осуществляется двумя водородными мостиками В···Н···В (связь трехцентровая двухэлектронная), расположенными в плоскости, перпендикулярной плоскости располо-
жения групп ВН2. Таким образом, каждый атом бора образует 4 σ-связи (sр3-
гибридизация), направленные к вершинам тетраэдра.
Диборан является исходным веществом для получения металлопроизводных боранов
— тетрагидридоборатов(1–) натрия и лития:
В2H6 + 2LiН = 2LiВН4
Кроме того, тетрагидридобораты(1–) образуются в следующей реакции: 4NaH + 2B2O3 = NaBH4 + 3NaBO2
Тетрагидридобораты находят широкое применение в лаборатории и в промышленности в качестве восстановителей.
1.2.4. Галогениды бора
Галогениды бора ВГ3 получают непосредственно из элементов при нагревании: 2В + 3Г2 = 2ВГ3
и взаимодействием оксида бора с углем в присутствии соответствующего галогена: 2В2О3 + 3С + 6Г2 = 4ВГ3 + 3СО2
Фторид бора можно получить действием фторида водорода на оксид бора:
В2О3 + 6НF = 2ВF3 + 3Н2O
В обычных условиях ВF3 — газ, ВСl3 и ВВr3 — жидкости, ВI3 — низкоплавкие кри-
сталлы. Все они являются галогеноангидридами борной кислоты и дымят на воздухе.
Хлорид, бромид и иодид бора необратимо разлагаются водой с образованием бор-
ной и галогеноводородной кислот:
ВГ3 + 3Н2О = Н3ВО3 + 3НГ Гидролиз фторида бора протекает в две ступени. Образующийся на первой стадии
фторид водорода
BF3 + 3H2O = H3BO3 + 3HF
связывает затем фторид бора во тетрафторидоборат водорода (тетрафтороборную кисло-
ту):
