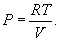- •1)Система отсчета. Материальная точка. Радиус-вектор и вектор перемещения, их связь с координатами точки. Траектория.
- •2)Средняя и мгновенная скорости. Ускорения. Закон равноускоренного движения.
- •3)Движения тела по окружности. Угловая скорость, нормальное и тангенциальное ускорение. Движение по криволейной траектории.
- •4)Инерциальные системы отсчета, первый закон Ньютона.
- •5)Масса и импульс материальной точки. Сила. Второй закон Ньютона.
- •6)Третий закон Ньютона. Преобразования Галилея.
- •7)Замкнутая система материальных точек. Закон сохранения импульса.
- •8)Центр масс, система центра масс.
- •9)Момент импульса, закон сохранения момента импульса.
- •10)Работа и мощность силы. Средняя и мгновенная мощность.
- •11)Консервативные силы, работа консервативных сил.
- •12)Потенциальная энергия. Закон сохранения механической энергии.
- •13)Упругие и квазиупругие силы. Закон Гука. Гармонические колебания: частота, период, амплитуда и фаза колебаний.
- •14)Дифференциальное уравнение гармонических колебаний. Гармонические колебания пружинного и математического маятников.
- •15)Затухающие колебания. Коэффициент затухания и логарифмический декремент затухания.
- •16)Энергия гармонических и затухающих колебаний.
- •17)Вынужденные колебания. Резонанс.
- •18)Основные положения молекулярно-кинетической теории. Масса и размеры молекул.
- •19)Термодинамическая система и параметры её состояния.
- •20)Связь кинетической энергии молекул газа с температурой и давлением.
- •21)Равнораспределение энергии по степеням свободы.
- •22)Число степеней свободы и средняя энергия многоатомной молекулы.
- •23)Внутреняя энергия термодинамической системы.Теплоёмкость.
- •24)Работа, совершаемая газом при изменении объема.
- •25)Распределение молекул газа по скоростям. Функция распределения и её нормировка. Функция распределения Максвелла.
- •26)Наиболее вероятная, средняя и средне-квадратичная скорости молекул.
- •27)Опыт Штерна
- •28)Опыт Ламмерта
- •29)Идеальный газ в поле сил тяжести, барометрическая формула. Распределения Больцмана.
- •30)Основы термодинамики.
- •31)Тепловые двигатели и их кпд.
- •32)Адиабатический процесс. Работа газа при различных процессах.
- •33)Круговой процесс. Цикл Карно. Кпд цикла Карно.
- •34)Уравнения состояния идеальных газов. Уравнение Ван-дер-Ваальса.
- •35)Приведенная теплота. Энтропия.
- •36)Изменения энтропии в изопроцессах.
- •37)Свободная и связанная энергии.
- •38)Статистический смысл энтропии.
18)Основные положения молекулярно-кинетической теории. Масса и размеры молекул.
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
В основе молекулярно-кинетической теории лежат три основных положения:
---Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
---Атомы и молекулы находятся в непрерывном хаотическом движении.
---Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Атомная единица массы (а.е.м.) - 1,6.10-27кг - единица массы, равная 1/12 массы изотопа углерода с массовым числом 12.
![]() ,
где m0 - масса молекулы (атома);
,
где m0 - масса молекулы (атома);
m0С - масса атома углерода (изотоп 12С)
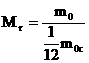 -
относительная атомная масса
-
относительная атомная масса
- определяется по таблице Менделеева!
Относительная молекулярная масса сложного вещества определяется как сумма относительных атомных масс всех атомов, входящих в состав данного вещества.
n - количество вещества; [n]=моль;
1 моль углерода имеет массу 0,012 кг
NA=6,02.1024 моль-1 - число (постоянная) Авогадро - количество структурных элементов (атомов, молекул) в 1 моле вещества (в 12 г углерода 12С).
![]() ,
где М - молярная масса (масса 1 моля);
,
где М - молярная масса (масса 1 моля);
![]() .
.
![]()
![]() -
концентрация - количество частиц в
единице объема вещества. [n]=м-3
-
концентрация - количество частиц в
единице объема вещества. [n]=м-3
![]() -
плотность - масса единицы объема
вещества. [r]= кг/м3.
-
плотность - масса единицы объема
вещества. [r]= кг/м3.
Оценим
размеры молекулы, считая, что молекулы
шарики.![]() ,
следовательно, используя понятия
плотности и молярной массы получим:
,
следовательно, используя понятия
плотности и молярной массы получим: 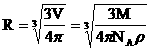
Например, для воды R»10-10м.
19)Термодинамическая система и параметры её состояния.
Термодинамическая система — это некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом. Также обычно полагается, что такая система подчиняется статистическим закономерностям. Для термодинамических систем справедливы законы термодинамики.
Для описания термодинамической системы вводят так называемые термодинамические величины — набор физических величин, значения которых определяют термодинамическое состояние системы. Примерами термодинамических величин являются:
-температура
-давление
-объем
-внутренняя энергия
-энтропия
-энтальпия
-свободная энергия Гельмгольца
-энергия Гиббса
В
состоянии термодинамического равновесия
для каждого вещества термодинамические
параметры связаны между собой так
называемым уравнением состояния:
![]()
Таким уравнением состояния для идеального газа является уравнение Менделеева – Клапейрона:
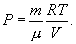
Здесь R=8,31 Дж/(мольК) – универсальная газовая постоянная, μ - молярная масса. Для углерода (С) величина μ составляет 12г, для водорода (H2) – 2г, для кислорода (О2) – 32г, для воды (Н2О) – 18г и т.д. Давление Р в системе СИ измеряется в ньютонах на квадратный метр или паскалях (Н/м2=Па), объем V – в кубических метрах (м2), масса m – в килограммах (кг), температура T – в кельвинах (К). Абсолютная температура Т отсчитывается от абсолютного нуля (-273,15°С), т.е. Т=t+273,15, где t – температура по Цельсию.
В
моле любого вещества содержится одно
и то же количество молекул N0, называемое
числом Авогадро:
![]()
Это
объясняется тем, что значение моля
любого вещества выбрано пропорциональным
массе молекулы этого вещества. Масса
молекулы может быть получена делением
массы моля на число Авогадро:
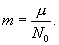
Отношение универсальной газовой постоянной R к числу Авогадро (т.е. универсальная газовая постоянная, приходящаяся на одну молекулу) называется постоянной Больцмана:
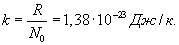
Если
количество вещества равно 1 молю, то