
- •1)Система отсчета. Материальная точка. Радиус-вектор и вектор перемещения, их связь с координатами точки. Траектория.
- •2)Средняя и мгновенная скорости. Ускорения. Закон равноускоренного движения.
- •3)Движения тела по окружности. Угловая скорость, нормальное и тангенциальное ускорение. Движение по криволейной траектории.
- •4)Инерциальные системы отсчета, первый закон Ньютона.
- •5)Масса и импульс материальной точки. Сила. Второй закон Ньютона.
- •6)Третий закон Ньютона. Преобразования Галилея.
- •7)Замкнутая система материальных точек. Закон сохранения импульса.
- •8)Центр масс, система центра масс.
- •9)Момент импульса, закон сохранения момента импульса.
- •10)Работа и мощность силы. Средняя и мгновенная мощность.
- •11)Консервативные силы, работа консервативных сил.
- •12)Потенциальная энергия. Закон сохранения механической энергии.
- •13)Упругие и квазиупругие силы. Закон Гука. Гармонические колебания: частота, период, амплитуда и фаза колебаний.
- •14)Дифференциальное уравнение гармонических колебаний. Гармонические колебания пружинного и математического маятников.
- •15)Затухающие колебания. Коэффициент затухания и логарифмический декремент затухания.
- •16)Энергия гармонических и затухающих колебаний.
- •17)Вынужденные колебания. Резонанс.
- •18)Основные положения молекулярно-кинетической теории. Масса и размеры молекул.
- •19)Термодинамическая система и параметры её состояния.
- •20)Связь кинетической энергии молекул газа с температурой и давлением.
- •21)Равнораспределение энергии по степеням свободы.
- •22)Число степеней свободы и средняя энергия многоатомной молекулы.
- •23)Внутреняя энергия термодинамической системы.Теплоёмкость.
- •24)Работа, совершаемая газом при изменении объема.
- •25)Распределение молекул газа по скоростям. Функция распределения и её нормировка. Функция распределения Максвелла.
- •26)Наиболее вероятная, средняя и средне-квадратичная скорости молекул.
- •27)Опыт Штерна
- •28)Опыт Ламмерта
- •29)Идеальный газ в поле сил тяжести, барометрическая формула. Распределения Больцмана.
- •30)Основы термодинамики.
- •31)Тепловые двигатели и их кпд.
- •32)Адиабатический процесс. Работа газа при различных процессах.
- •33)Круговой процесс. Цикл Карно. Кпд цикла Карно.
- •34)Уравнения состояния идеальных газов. Уравнение Ван-дер-Ваальса.
- •35)Приведенная теплота. Энтропия.
- •36)Изменения энтропии в изопроцессах.
- •37)Свободная и связанная энергии.
- •38)Статистический смысл энтропии.
28)Опыт Ламмерта
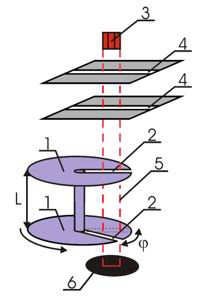
Прямые измерения скорости атомов ртути в пучке были выполнены в 1929 году Ламмертом. Упрощенная схема этого эксперимента показана на рис. 5.6.
|
Рис. 5.6. Схема опыта Ламмерта 1 - быстро вращающиеся диски, 2 - узкие щели, 3 - печь, 4 - коллиматор, 5 - траектория молекул, 6 - детектор |
Два
диска 1, насаженные на общую ось, имели
радиальные прорези 2, сдвинутые друг
относительно друга на угол ![]() .
Напротив щелей находилась печь 3, в
которой нагревался до высокой температуры
легкоплавкий металл. Разогретые атомы
металла, в данном случае ртути, вылетали
из печи и с помощью коллиматора 4
направлялись в необходимом направлении.
Наличие двух щелей в коллиматоре
обеспечивало движение частиц между
дисками по прямолинейной траектории
5, параллельной их оси. В установке
Ламмерта в дисках было сделано множество
щелей (они на рисунке не изображены) с
целью увеличения интенсивности прошедшего
пучка. Далее атомы, прошедшие прорези
в дисках, регистрировались с помощью
детектора 6. Вся описанная установка
помещалась в глубокий вакуум.
.
Напротив щелей находилась печь 3, в
которой нагревался до высокой температуры
легкоплавкий металл. Разогретые атомы
металла, в данном случае ртути, вылетали
из печи и с помощью коллиматора 4
направлялись в необходимом направлении.
Наличие двух щелей в коллиматоре
обеспечивало движение частиц между
дисками по прямолинейной траектории
5, параллельной их оси. В установке
Ламмерта в дисках было сделано множество
щелей (они на рисунке не изображены) с
целью увеличения интенсивности прошедшего
пучка. Далее атомы, прошедшие прорези
в дисках, регистрировались с помощью
детектора 6. Вся описанная установка
помещалась в глубокий вакуум.
При
вращении дисков с постоянной угловой
скоростью ![]() ,
через их прорези беспрепятственно
проходили только атомы, имевшие
скорость
,
через их прорези беспрепятственно
проходили только атомы, имевшие
скорость ![]() :
:
|
(5.75) |
где ![]() -
расстояние между вращающимися дисками.
-
расстояние между вращающимися дисками.
Изменяя
угловую скорость вращения дисков можно
было отбирать из пучка молекулы, имеющие
определенную скорость ![]() ,
и по регистрируемой детектором
интенсивности судить об относительном
содержании их в пучке.
,
и по регистрируемой детектором
интенсивности судить об относительном
содержании их в пучке.
Таким способом удалось экспериментально проверить статистический закон распределения молекул по скоростям.
29)Идеальный газ в поле сил тяжести, барометрическая формула. Распределения Больцмана.
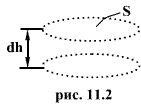
Выделим
горизонтальный элемент объема газа
высотой dh и площадью основания S (рис.
11.2). Считаем газ однородным и температуру
его постоянной. Число молекул в этом
объеме равно произведению его объема
dV=Sdh на число молекул ![]() в
единице объема. Полный вес молекул в
выделенном элементе равен
в
единице объема. Полный вес молекул в
выделенном элементе равен
![]()
Действие
веса dF вызывает давление, равное
![]() (11.2)
(11.2)
минус
- т.к. при увеличении dh давление уменьшается.
Согласно основному уравнению
молекулярно-кинетической теории
![]() (11.3)
(11.3)
Приравнивая правые части (11.2) и (11.3), получаем
![]() или
или
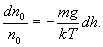
Интегрируя
это выражение в пределах от ![]() до
h (соответственно концентрация изменяется
от
до
n):
до
h (соответственно концентрация изменяется
от
до
n):
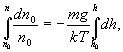 получим
получим
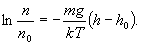
Потенцируя
полученное выражение, находим
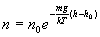
Если учесть, что Р=nkT, то нетрудно получить следующее уравнение
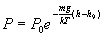
где ![]() -
давление газа на высоте
.
За
часто
выбирают уровень моря, т.е. полагают
-
давление газа на высоте
.
За
часто
выбирают уровень моря, т.е. полагают ![]() ,
и тогда
представляет
собой атмосферное давление на поверхности
Земли, Р - давление газа на высоте h.
,
и тогда
представляет
собой атмосферное давление на поверхности
Земли, Р - давление газа на высоте h.
Это выражение называется барометрической формулой. Из полученных уравнений следует, что как концентрация молекул, так и давление уменьшаются с высотой по экспоненциальному закону.
30)Основы термодинамики.
Термодинамическое
состояние тела (например, газа)
характеризуется его массой ![]() ,
молярной массой μ, давлением
,
молярной массой μ, давлением ![]() ,
объемом
,
объемом ![]() ,
температурой
,
температурой ![]() (а
возможно, и другими величинами, например,
определяющими его химический состав).
Все эти величины называются
термодинамическими параметрами тела.
Однако, как будет видно из дальнейшего,
такие параметры, как
(а
возможно, и другими величинами, например,
определяющими его химический состав).
Все эти величины называются
термодинамическими параметрами тела.
Однако, как будет видно из дальнейшего,
такие параметры, как ![]() ,имеют
смысл только тогда, когда тело находится,
хотя бы приближенно, в так называемом
состоянии термодинамического равновесия
(т.д.р.). Так называется состояние, в
котором все термодинамические параметры
остаются со временем постоянными (к
этому следует добавить еще условие
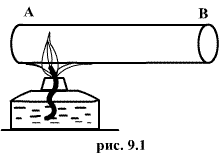
отсутствия стационарных потоков). Если,
например, быстро подогревать газ, как
это показано на рис. 9.1, температура
непосредственно подогреваемой части
сосуда А окажется выше температуры
части В. Не будут равны и давления в
частях А и В. В этом случае не имеет
смысла понятие температуры
или
давления
всего
газа. Другой пример – впустим в газ
пучок быстрых молекул. Ясно, что не имеет
смысла говорить о температуре газа до
тех пор, пока быстрые молекулы, вследствие
ряда столкновений с другими, не приобретут
скоростей порядка средней скорости
остальных молекул, иначе говоря, пока
система не придет в состояние т.д.р.
,имеют
смысл только тогда, когда тело находится,
хотя бы приближенно, в так называемом
состоянии термодинамического равновесия
(т.д.р.). Так называется состояние, в
котором все термодинамические параметры
остаются со временем постоянными (к
этому следует добавить еще условие
отсутствия стационарных потоков). Если,
например, быстро подогревать газ, как
это показано на рис. 9.1, температура
непосредственно подогреваемой части
сосуда А окажется выше температуры
части В. Не будут равны и давления в
частях А и В. В этом случае не имеет
смысла понятие температуры
или
давления
всего
газа. Другой пример – впустим в газ
пучок быстрых молекул. Ясно, что не имеет
смысла говорить о температуре газа до
тех пор, пока быстрые молекулы, вследствие
ряда столкновений с другими, не приобретут
скоростей порядка средней скорости
остальных молекул, иначе говоря, пока
система не придет в состояние т.д.р.
В состоянии т.д.р. для каждого вещества термодинамические параметры связаны между собой так называемым уравнением состояния:
Таким уравнением состояния для идеального газа является уравнение Менделеева – Клапейрона: (9.2)
Здесь R=8,31 Дж/(мольК) – универсальная газовая постоянная, μ - молярная масса. Для углерода (С) величина μ составляет 12г, для водорода (H2) – 2г, для кислорода (О2) – 32г, для воды (Н2О) – 18г и т.д.
В моле любого вещества содержится одно и то же количество молекул N0, называемое числом Авогадро:
Это объясняется тем, что значение моля любого вещества выбрано пропорциональным массе молекулы этого вещества. Масса молекулы может быть получена делением массы моля на число Авогадро:
Отношение универсальной газовой постоянной R к числу Авогадро (т.е. универсальная газовая постоянная, приходящаяся на одну молекулу) называется постоянной Больцмана:
В формулу (9.2) входят еще давление, объем, температура и масса газа. Давление Р в системе СИ измеряется в ньютонах на квадратный метр или паскалях (Н/м2=Па), объем V – в кубических метрах (м2), масса m – в килограммах (кг), температура T – в кельвинах (К). Абсолютная температура Т отсчитывается от абсолютного нуля (-273,15°С), т.е. Т=t+273,15, где t – температура по Цельсию.
Если количество вещества равно 1 молю, то (9.2) превращается в

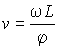 ,
,