
- •1)Система отсчета. Материальная точка. Радиус-вектор и вектор перемещения, их связь с координатами точки. Траектория.
- •2)Средняя и мгновенная скорости. Ускорения. Закон равноускоренного движения.
- •3)Движения тела по окружности. Угловая скорость, нормальное и тангенциальное ускорение. Движение по криволейной траектории.
- •4)Инерциальные системы отсчета, первый закон Ньютона.
- •5)Масса и импульс материальной точки. Сила. Второй закон Ньютона.
- •6)Третий закон Ньютона. Преобразования Галилея.
- •7)Замкнутая система материальных точек. Закон сохранения импульса.
- •8)Центр масс, система центра масс.
- •9)Момент импульса, закон сохранения момента импульса.
- •10)Работа и мощность силы. Средняя и мгновенная мощность.
- •11)Консервативные силы, работа консервативных сил.
- •12)Потенциальная энергия. Закон сохранения механической энергии.
- •13)Упругие и квазиупругие силы. Закон Гука. Гармонические колебания: частота, период, амплитуда и фаза колебаний.
- •14)Дифференциальное уравнение гармонических колебаний. Гармонические колебания пружинного и математического маятников.
- •15)Затухающие колебания. Коэффициент затухания и логарифмический декремент затухания.
- •16)Энергия гармонических и затухающих колебаний.
- •17)Вынужденные колебания. Резонанс.
- •18)Основные положения молекулярно-кинетической теории. Масса и размеры молекул.
- •19)Термодинамическая система и параметры её состояния.
- •20)Связь кинетической энергии молекул газа с температурой и давлением.
- •21)Равнораспределение энергии по степеням свободы.
- •22)Число степеней свободы и средняя энергия многоатомной молекулы.
- •23)Внутреняя энергия термодинамической системы.Теплоёмкость.
- •24)Работа, совершаемая газом при изменении объема.
- •25)Распределение молекул газа по скоростям. Функция распределения и её нормировка. Функция распределения Максвелла.
- •26)Наиболее вероятная, средняя и средне-квадратичная скорости молекул.
- •27)Опыт Штерна
- •28)Опыт Ламмерта
- •29)Идеальный газ в поле сил тяжести, барометрическая формула. Распределения Больцмана.
- •30)Основы термодинамики.
- •31)Тепловые двигатели и их кпд.
- •32)Адиабатический процесс. Работа газа при различных процессах.
- •33)Круговой процесс. Цикл Карно. Кпд цикла Карно.
- •34)Уравнения состояния идеальных газов. Уравнение Ван-дер-Ваальса.
- •35)Приведенная теплота. Энтропия.
- •36)Изменения энтропии в изопроцессах.
- •37)Свободная и связанная энергии.
- •38)Статистический смысл энтропии.
35)Приведенная теплота. Энтропия.
Рассмотрим обратимый и необратимый циклы Карно
Обратимый
цикл Карно.Для обратимого цикла
коэффициент полезного действия можно
вычислить по любой из полученных ранее
формул
![]() Отсюда
Отсюда
![]() или
или ![]()
-
количество тепла, подводимое к системе
в процессе перехода из состояния 1 в
состояние 2.
-
отведенное тепло в течение изотермического
процесса 3-4. Или для случая отвода тепла
можно сказать, что к системе
подведено ![]() тепла.
Тогда
тепла.
Тогда
![]()
Отношение количества
теплоты, подведенной к системе, к
температуре, при которой это происходит,
называется приведенной теплотой. Таким
образом, ![]() -
приведенная теплота, передаваемая
системе.
-
приведенная теплота, передаваемая
системе. ![]() -
приведенная теплота в 1 процессе.
-
приведенная теплота в 1 процессе.![]() -
приведенная теплота во II процессе. На
участках 2-3 и 4-1 Q=0. Следовательно, это
вся теплота охватывающая цикл Карно.
Таким образом, для обратимого цикла
Карно
-
приведенная теплота во II процессе. На
участках 2-3 и 4-1 Q=0. Следовательно, это
вся теплота охватывающая цикл Карно.
Таким образом, для обратимого цикла
Карно
![]()
Так
как любой замкнутый цикл можно представить
как сумму бесконечного числа циклов
Карно, то для любого замкнутого обратимого
цикла выражение будет справедливо и
его можно записать в следующем виде
![]()
Последнее соотношение носит название равенства Клаузиуса.
Необратимый
цикл Карно.В этом случае
![]()
И
все равенства превращаются в неравенства
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() - Уравнение
называется неравенством Клаузиуса.
- Уравнение
называется неравенством Клаузиуса.
Из
теоремы Клаузиуса следует, что приведенная
теплота подобно энергии (потенциальной,
внутренней) является функцией состояния
(не зависит от пути перехода и зависит
только от состояния системы). Независимость
интеграла
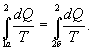
от
пути перехода означает, что этот интеграл
выражает собой изменение некоторой
функции состояния системы, она
называется энтропия и обозначается
буквой S. Изменение энтропии системы,
очевидно, равно
![]()
Мы
говорим только об изменении энтропии
(подобно изменению потенциальной
энергии ![]() ,
для которой не важно где начало отсчета).
Из уравнения вытекает основное
количественное выражение второго начала
термодинамики
,
для которой не важно где начало отсчета).
Из уравнения вытекает основное
количественное выражение второго начала
термодинамики
![]()
36)Изменения энтропии в изопроцессах.
Энтропия системы является функцией ее состояния, определенная с точностью до произвольной постоянной. Если система совершает равновесный переход из состояния 1 в состояние 2, то изменение энтропии
|
|
|
(6.2.1) |
Таким образом, по формуле (6.2.1) можно определить энтропию лишь с точностью до аддитивной постоянной, т.е. начало энтропии произвольно. Физический смысл имеет лишь разность энтропий. Исходя из этого, найдем изменения энтропии в процессах идеального газа. Так как при Т = const,
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(6.2.2) |
Таким образом, изменение энтропии ΔS1-2 идеального газа при переходе его из состояния 1 в состояние 2 не зависит от вида перехода 1 - 2. Каждый из изопроцессов идеального газа характеризуется своим изменением энтропии, а именно:
изохорический: ![]() ,
т.к.
,
т.к. ![]() ;
;
изобарический: 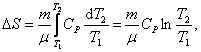 т.к. Р1 =
Р2;
т.к. Р1 =
Р2;
изотермический: ![]() т.к.
т.к. ![]() ;
;
адиабатический: ![]() ,
т.к.
,
т.к. ![]()
Отметим, что в
последнем случае адиабатический процесс
называют изоэнтропийным процессом,
т.к. ![]() .
.

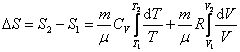 ,
или
,
или