
- •2. Стереохимия амк
- •4. Синтез жк
- •5. Ферм-ты,их отличие от химических катализаторов
- •6. Какими путями при обмене амк обр-ется аммиак, роль глутамина и аспарагина в обмене в-в. Дезаминирование амк
- •2. Мажорные-минорные осн, пуриновые-пиримидиновые
- •3. Общ хар. Сахаров, тригалозный сахар
- •Трегалоза (-d-глюкопиранозил-(11)--d-глюкопиранозид) – невосстанавливающий резервный дисахарид грибов и насекомых.
- •5. Оксидоредуктазы
- •6. Бэта окисление жирн кислот.
- •1 Таутомерные превращения азот.Оснований
- •2 Гликозиды написать формулу метил-альфа-d-глюкозогликозид
- •3 Написать формулу кардиолипина и написать их хар-ку
- •4 Кинетика фер-тативных процессов ур-ние михаэлис-Мэнтен
- •6 Цикл глюкоза в лактат и сколько нужно и затрачено атф
- •1.МРнк строение и роль
- •3.Арахидоновая кисл и её произв(пг)
- •4.Изомеразы.Общая хар-ка,примеры реакций
- •5.Как влияет концентрац......(константа мих-мэнтоса)
- •6.Дых цепь
- •6 Биосинтез белка
- •2. Общая хар-ристика лигаз
- •3. Биосинтез рнк
- •5. Изоф-ты, функции
- •6. Цикл пировиноградной к-ты
- •3. Таутомерия глюкозы и что такое мутаротация
- •6. Рилизинг-факторы (либерины)
- •1. Факторы, влияющие на скорость ферм. Реакции
- •2. Биосинтез триглицерина и глицеролфосфолипидов биосинтез триглицеридов
- •3. Стр. Нуклеотида
- •5. Горм. Гипофиза
- •Вазопрессин и окситоцин
- •Меланоцитстимулирующие гормоны (мсг, меланотропины)
- •Адренокортикотропный гормон (актг, кортикотропин)
- •Соматотропный гормон (стг, гормон роста, соматотропин)
- •Лактотропный гормон (пролактин, лютеотропный гормон)
- •Тиреотропный гормон (ттг, тиротропин)
- •Гонадотропные гормоны (гонадотррпины)
- •Липотропные гормоны (лтг, липотропины)
- •1 Отличия и сходста днк и рнк
- •2 Произв. Моносахаридов: кислоты, гликозиды, аминосахара
- •3 Роль тиреоидных гормонов
- •4 Оксиредуктазы
- •2 Гормоны поджелудочной железы...Функции ....Строение...
- •Глюкагон
- •3 Гетерогликаны
- •4 Классы ф-тов
- •5 Аллостерическая активность ф-тов.
- •14 Билет
- •3 Горомны гипоталамусса, их природа и ролль...
- •4 Специфичность ф-тов
- •3) Хим. Природа связей, стабилизирующих первичную и вторичную стр-ру белков и нуклеиновых к-т
- •4) Гомогликаны (строение, функции)
- •5) Пиридоксин, его роль в регуляции белкового обмена, переаминирование(механизм р-ии и роль в метаболизме)
- •2. Гормоны,как производные амк, гормональный цикл
- •4. Лигазы(ферм-ты),их функции.
- •5. Гормональная регуляция акт-сти ф-та с пом вторичных посредников.
- •6. Пентозофосфатный путь(пфп) окисления ув
- •Основные р-ции моносахаридов, продукты р-ций и их св-ва
- •2. Пептиды
- •1. Структурная организация фермента
- •Активный центр ферментов.
- •2. Регуляторные центры
- •4. Общая классификация витаминов
- •5. Гликогенез и его роль Синтез гликогена (гликогенез)
- •1)Гликофосфолипиды
- •2) Однокомпонентные и двухкомпонентные ф-ты
- •4)Гликозиды, к-ты,моносахара,как производные монасахаридов
- •5)Мембрано-опосредованное вз-действие гормонов
- •6)Катаболизм амк
- •1. Стеролы и стероиды
- •2. Лактоза и ее св-ва
- •Роль тРнк
- •1.Макроэргические соединения
- •2.Гидролазы, роль
- •3.Арахидоновая кислота и ее роль в метаболизме и произв
- •5.Ингибирование, виды. Константа Михаэлиса и зависимость
- •6.Свободное окисление, его роль в антиоксидантном механизме
3 Написать формулу кардиолипина и написать их хар-ку
Кардиолипин. Своеобразным представителем глицерофосфолипидов явл кардиолипин, впервые выделен из сердечной мышцы. По своей хим стр-ре кардиолипин можно рассм-ть как соед-ние, в к-ром 2 мол-лы фосфатидной к-ты связаны с помощью одной мол-лы глицерина. В отличие от остальных глицерофосфолипидов кар-диолипин явл как бы «двойным» глицерофосфолипидом. Кардио-липин локализован во внутренней мембране митохондрий. Функция его пока неясна, хотя известно, что в отличие от других фосфолипидов кардиолипин обладает иммунными св-вами.
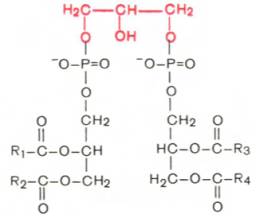
Кардиолипин
4 Кинетика фер-тативных процессов ур-ние михаэлис-Мэнтен
Общие принципы кинетики хим р-ций применимы и к ф-тативным р-циям. Известно, что любая хим р-ция хар-ризуется константой термодинамич равновесия. Она выражает состояние химического равновесия, достигаемого системой, и обозначается Кр. Так, для р-ции:
![]()
константа равновесия равна произведению конц-ций образующихся в-в, деленному на произведение конц-ции исходных в-в. Значение константы равновесия обычно нах из соотнош констант скоростей прямой (k+1) и обратной (k– 1 ) р-ций, т.е. Кp = k+1/k–1. В состоянии равновесия скорость прямой р-ции: v+1 = k + 1[ А ] • [ B ] равна скорости обратной р-ции: v–1 = k – 1 [ С ] • [ D ] , т. е. v+1 = v–1 соотв-енно k+1[А]•[B] = k–1[С]•[D], или
![]()
Т.об., константа равновесия = отнош констант скоростей прямой и обратной р-ций. Величину, обратную константе равновесия, принято называть субстратной константой, или, в случае ф-тативной р-ции, константой диссоциации ф-т–субстратного комплекса, и обозначать символом KS. Так, в р-ции
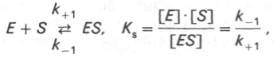
т.е. KSравна отношению произведения конц-ции ф-та и субстрата к конц-ции ф-т-субстратного комплекса или отнош констант скоростей обратной и прямой р-ций. Константа KS зависит от хим природы субстрата и ф-та и определяет степень их сродства. Чем ниже значение KS, тем выше сродство ф-та к субстрату.
При низкой конц-ции субстрата зависимость скор р-ции от конц-ции субстрата явл почти линейной и подчиняется кинетике первого порядка. Это означает, что скорость р-ции S —> Р прямо пропорц конц-ции субстрата S и в любой момент времени t определяется след кинетическим ур-нием:
![]() где
[S] – молярная конц-ция
субс-та
S; –d[S]/dt – скор убыли субстрата;
k' – константа
скорости
р-ции,
к-рая имеет размерность, обратную единице
времени (мин–1
или с–1).
где
[S] – молярная конц-ция
субс-та
S; –d[S]/dt – скор убыли субстрата;
k' – константа
скорости
р-ции,
к-рая имеет размерность, обратную единице
времени (мин–1
или с–1).
При высокой конц-ции субстрата скор р-ции максимальна, стан-тся пост и не зависящей от конц-ции субстрата [ S ] . В этом случае р-ция подчиняется кинетике нулевого порядка v = k" (при полном насыщении ф-та субстратом) и целиком определ-ся конц-цией ф-та. Различают р-ции 2-ого порядка, скорость к-рых пропорциональна произведению конц-ций двух реагирующих в-в. В определенных условиях при нарушении пропорциональности говорят иногда о р-циях смешанного порядка.
Изучая явление насыщения, Л. Михаэлис и М. Ментен разработали общую теорию ф-тативной кинетики. Они исходили из предположения, что ф-тативный процесс протекает в виде след хим р-ции:
![]() т.е.
ф-т
Е вступает во вз-действие с субстратом
S с обр-нием промежуточного комплекса
ES, к-рый далее распадается на свободный
ф-т
и продукт р-ции
Р. Матем обработка на основе закона
действующих масс
дала возм-сть вывести ур-ние, названное
в честь авторов ур-ем Михаэлиса–Ментен,
выражающ кол-ное соотнош м/у конц-цией
субстрата
и скор ф-тативной р-ции:
т.е.
ф-т
Е вступает во вз-действие с субстратом
S с обр-нием промежуточного комплекса
ES, к-рый далее распадается на свободный
ф-т
и продукт р-ции
Р. Матем обработка на основе закона
действующих масс
дала возм-сть вывести ур-ние, названное
в честь авторов ур-ем Михаэлиса–Ментен,
выражающ кол-ное соотнош м/у конц-цией
субстрата
и скор ф-тативной р-ции:
![]() где
v – скор
р-ции
при данной конц-ции
субстрата
[S]; KS–
константа
диссоциации
ф-т-субстратного комплекса, моль/л;
Vmax–
максим скор
р-ции
при полном насыщении ф-та
субстратом.
где
v – скор
р-ции
при данной конц-ции
субстрата
[S]; KS–
константа
диссоциации
ф-т-субстратного комплекса, моль/л;
Vmax–
максим скор
р-ции
при полном насыщении ф-та
субстратом.
Из ур-ния Михаэлиса–Ментен следует, что при высокой конц-ции субстрата и низком значении KS скор р-ции явл максим, т.е. v = Vmax. При низкой конц-ции субстрата, напротив, скорость р-ции оказывается пропорциональной конц-ции субстрата в каждый данный момент (р-ция первого порядка).
Следует
указать, что ур-ние Михаэлиса–Ментен
в его классическом виде не учитывает
влияние на скорость ф-тативного проц
продуктов р-ции,
напр в р-ции
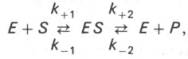 и
носит несколько ограниченный хар-р.
Поэтому были предприняты попытки
усовершенствовать его. Так, было
предложено ур-ние Бриггса-Холдейна:
и
носит несколько ограниченный хар-р.
Поэтому были предприняты попытки
усовершенствовать его. Так, было
предложено ур-ние Бриггса-Холдейна:
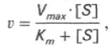 где
Кm
представляет собой константу
Михаэлиса, являющуюся экспериментально
определяемой величиной. Она может быть
представлена следующим ур-нием:
где
Кm
представляет собой константу
Михаэлиса, являющуюся экспериментально
определяемой величиной. Она может быть
представлена следующим ур-нием:
![]()
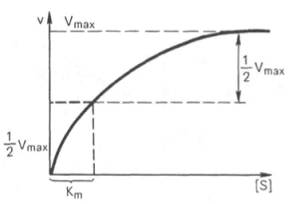 Кривая
ур-ния Михаэли-са-Ментен: гиперболическая
зависимость начальных скоростей
катализируемой ф-том
р-ции
от конц-ции
субстрата.
Кривая
ур-ния Михаэли-са-Ментен: гиперболическая
зависимость начальных скоростей
катализируемой ф-том
р-ции
от конц-ции
субстрата.
В
числителе представлены константы
скоростей
распада комплекса ES в двух направлениях
(в сторону исходных Е и S и в сторону
конечных продуктов р-ции
Е и Р). Отношение k–1/
k+1представляет
собой константу
диссоциации
ф-тсубстратного комплекса KS,
тогда:
![]()
Отсюда вытекает важное следствие: константа Михаэлиса всегда больше константы диссоциации ф-т-субстратного комплекса KSна величину k+2/k+1.
Для определения численного значения Кm обычно находят ту конц-цию субстрата, при к-рой скорость ф-тативной р-ции v составляет половину от максимальной Vmax, т.е. если v = 1/2 Vmaх. Подставляя значение v в ур-ние Бриггса–Холдейна, получаем:
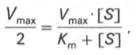
разделив обе части ур-ния на Vmах, получим
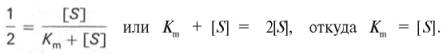
Т.об., константа Михаэлиса численно равна конц-ции субстрата (моль/л), при к-рой скорость данной ф-тативной р-ции составляет половину от максимальной.
Определение величины Кm имеет важное значение при выяснении механизма действия эффекторов на активность ф-тов и т.д. Константу Михаэлиса можно вычислить по графику (рис. 4.13). Отрезок на абсциссе, соотв-ующий скорости, равной половине максимальной, будет представлять собой Кm.
Пользоваться графиком, построенным в прямых координатах зависимости начальной скорости р-ции v0 от начальной конц-ции субстрата [S0], неудобно, поскольку максимальная скорость Vmaxявл в данном случае асимптотической величиной и определяется недостаточно точно.
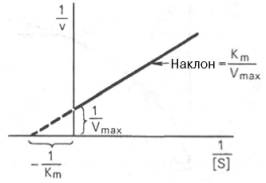 График
Лайнуивера-Бэрка.
График
Лайнуивера-Бэрка.
Для более удобного графического представления экспериментальных данных Г. Лайнуивер и Д. Бэрк преобразовали ур-ние Бриггса–Хол-дейна по методу двойных обратных величин исходя из того принципа, что если существует равенство м/у двумя какими-либо величинами, то и обратные величины также будут равны. В частности, если
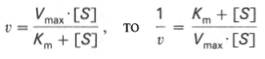 или
или

то после преобр-ния получаем ур-ние:
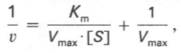
к-рое получило название ур-ния Лайнуивера–Бэрка. Это ур-ние прямой линии: у = ах + b. Если теперь в соотв-ии с этим ур-нием построить график в координатах 1/v (y) от l/[S] (x), то получим прямую линию (рис. 4.14), тангенс угла наклона к-рый будет равен величине Km/Vmax; отрезок, отсекаемый прямой от оси ординат, представляет собой l/Vmax(обратная величина максимальной скорости). Если продолжить прямую линию за ось ординат, тогда на абсциссе отсекается отрезок, соотв-ующий обратной величине константы Михаэлиса – 1/Кm (см. рис. 4.14). Т.об., величину Кm можно вычислить из данных наклона прямой и длины отрезка, отсекаемого от оси ординат, или из длины отрезка, отсекаемого от оси абсцисс в области отрицательных значений.
Следует подчеркнуть, что значения Vmax, как и величину Кm, более точно, чем по графику, построенному в прямых координатах, можно определить по графику, построенному по методу двойных обратных величин. Поэтому данный метод нашел широкое применение в современной энзимологии. Предложены также аналогичные графические способы определения Кm и Vmaxв координатах зависимости v от v/[S] и [S]/v от [S].
Следует отметить нек-рые ограничения применения ур-ния Ми-хаэлиса–Ментен, обусловленные множественными формами ф-тов и аллостерической природой ф-та. В этом случае график зависимости начальной скорости р-ции от конц-ции субстрата (кинетическая кривая) имеет не гиперболическую форму, а сигмоидный хар-р наподобие кривой насыщения гемоглобина кислородом. Это означает, что связывание одной мол-лы субстрата в одном каталитическом центре повышает связывание субстрата с другим центром, т.е. имеет место кооперативное вз-действие, как и в случае присоединения кислорода к 4 субъединицам гемоглобина. Для оценки конц-ции субстрата, при к-рой скорость р-ции составляет половину максимальной, в условиях сигмоидного хар-ра кинетической кривой обычно применяют преобр-нное ур-ние Хилла:
