
- •2. Стереохимия амк
- •4. Синтез жк
- •5. Ферм-ты,их отличие от химических катализаторов
- •6. Какими путями при обмене амк обр-ется аммиак, роль глутамина и аспарагина в обмене в-в. Дезаминирование амк
- •2. Мажорные-минорные осн, пуриновые-пиримидиновые
- •3. Общ хар. Сахаров, тригалозный сахар
- •Трегалоза (-d-глюкопиранозил-(11)--d-глюкопиранозид) – невосстанавливающий резервный дисахарид грибов и насекомых.
- •5. Оксидоредуктазы
- •6. Бэта окисление жирн кислот.
- •1 Таутомерные превращения азот.Оснований
- •2 Гликозиды написать формулу метил-альфа-d-глюкозогликозид
- •3 Написать формулу кардиолипина и написать их хар-ку
- •4 Кинетика фер-тативных процессов ур-ние михаэлис-Мэнтен
- •6 Цикл глюкоза в лактат и сколько нужно и затрачено атф
- •1.МРнк строение и роль
- •3.Арахидоновая кисл и её произв(пг)
- •4.Изомеразы.Общая хар-ка,примеры реакций
- •5.Как влияет концентрац......(константа мих-мэнтоса)
- •6.Дых цепь
- •6 Биосинтез белка
- •2. Общая хар-ристика лигаз
- •3. Биосинтез рнк
- •5. Изоф-ты, функции
- •6. Цикл пировиноградной к-ты
- •3. Таутомерия глюкозы и что такое мутаротация
- •6. Рилизинг-факторы (либерины)
- •1. Факторы, влияющие на скорость ферм. Реакции
- •2. Биосинтез триглицерина и глицеролфосфолипидов биосинтез триглицеридов
- •3. Стр. Нуклеотида
- •5. Горм. Гипофиза
- •Вазопрессин и окситоцин
- •Меланоцитстимулирующие гормоны (мсг, меланотропины)
- •Адренокортикотропный гормон (актг, кортикотропин)
- •Соматотропный гормон (стг, гормон роста, соматотропин)
- •Лактотропный гормон (пролактин, лютеотропный гормон)
- •Тиреотропный гормон (ттг, тиротропин)
- •Гонадотропные гормоны (гонадотррпины)
- •Липотропные гормоны (лтг, липотропины)
- •1 Отличия и сходста днк и рнк
- •2 Произв. Моносахаридов: кислоты, гликозиды, аминосахара
- •3 Роль тиреоидных гормонов
- •4 Оксиредуктазы
- •2 Гормоны поджелудочной железы...Функции ....Строение...
- •Глюкагон
- •3 Гетерогликаны
- •4 Классы ф-тов
- •5 Аллостерическая активность ф-тов.
- •14 Билет
- •3 Горомны гипоталамусса, их природа и ролль...
- •4 Специфичность ф-тов
- •3) Хим. Природа связей, стабилизирующих первичную и вторичную стр-ру белков и нуклеиновых к-т
- •4) Гомогликаны (строение, функции)
- •5) Пиридоксин, его роль в регуляции белкового обмена, переаминирование(механизм р-ии и роль в метаболизме)
- •2. Гормоны,как производные амк, гормональный цикл
- •4. Лигазы(ферм-ты),их функции.
- •5. Гормональная регуляция акт-сти ф-та с пом вторичных посредников.
- •6. Пентозофосфатный путь(пфп) окисления ув
- •Основные р-ции моносахаридов, продукты р-ций и их св-ва
- •2. Пептиды
- •1. Структурная организация фермента
- •Активный центр ферментов.
- •2. Регуляторные центры
- •4. Общая классификация витаминов
- •5. Гликогенез и его роль Синтез гликогена (гликогенез)
- •1)Гликофосфолипиды
- •2) Однокомпонентные и двухкомпонентные ф-ты
- •4)Гликозиды, к-ты,моносахара,как производные монасахаридов
- •5)Мембрано-опосредованное вз-действие гормонов
- •6)Катаболизм амк
- •1. Стеролы и стероиды
- •2. Лактоза и ее св-ва
- •Роль тРнк
- •1.Макроэргические соединения
- •2.Гидролазы, роль
- •3.Арахидоновая кислота и ее роль в метаболизме и произв
- •5.Ингибирование, виды. Константа Михаэлиса и зависимость
- •6.Свободное окисление, его роль в антиоксидантном механизме
6.Дых цепь
Тканевое дыхание и биологическое окисление. Распад органических соединений в живых тканях, сопровождающийся потреблением молекулярного кислорода и приводящий к выделению углекислого газа и воды и обр-нию биологических видов энергии, наз тканевым дыханием. Тканевое дыхание представляют как конечный этап пути превращений моносахаров (в основном глюкозы) до указанных конечных продуктов, в к-ый на разных стадиях включаются другие сахара и их производные, а также промежуточные продукты распада липидов (ЖК), белков (АМКы) и нуклеиновых оснований. Итоговая реакция тканевого дыхания будет выглядеть следующим образом:
С6Н12О6 + 6O2 = 6СO2+ 6Н2O + 2780 кДж/моль. (1)
Использование клетками кислорода открывает возможности для более полного окисления субстратов. В аэробных условиях продукты бескислородного окисления становятся субстратами цикла трикарбоновых кислот, в ходе которого образуются восстановленные дыхательные переносчики НАДФН, НАДН и флавиновые коферменты. Способность НАД+ и НАДФ+ играть роль промежуточного переносчика водорода связана с наличием в их структуре амида никотиновой кислоты. При взаимодействии этих кофакторов с атомами водорода имеет место обратимое гидрирование (присоединение атомов водорода):
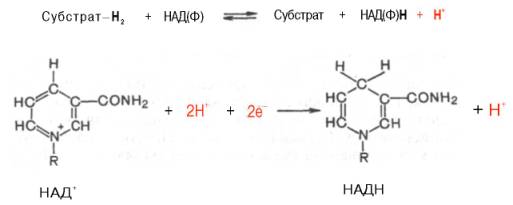
При этом в молекулу НАД+ (НАДФ+) включаются 2 электрона и один протон, а второй протон остается в среде.
Во флавиновых коферментах (ФАД или ФМН), активной частью молекул которых является изоаллоксазиновое кольцо, в результате восстановления чаще всего наблюдается присоединение 2 протонов и 2 электронов одновременно:
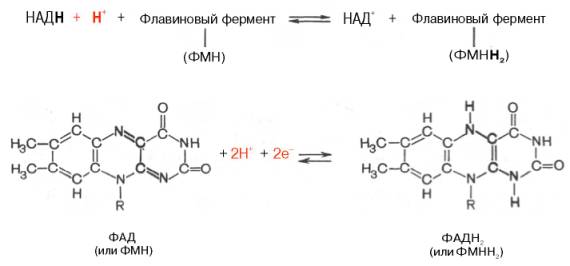
Восстановленные формы этих кофакторов способны транспортировать водород и электроны к дых цепи митохондрий или иных энерго-сопрягающих мембран.
Организация и функционирование дыхательной цепи. В ЭКК дых цепь располож во внутр мембране митох, у дышащих бактерий – в цитоплазматической мембране и специализированных структурах – мезосомах, или тилакоидах.
Молярные соотнош компонентов дых цепи явл пост, ее компоненты встроены в митохондр мембрану в виде 4 белково-липидных комплексов: НАДН-КоQН2-редуктаза (комплекс I), сукцинат-КоQ-редуктаза (комплекс II), КоQН2-цитохром c-редуктаза (комплекс III) и цитохром а-цитохромокси-даза (комплекс IV).
Если субстратом окисления служат α-кетокислоты, в переносе электронов на НАД+ участвуют липоатсодержащие дегидрогеназы. В случае окисления пролина, глутамата, изоцитрата и других субстратов перенос электронов происходит непосредственно на НАД+. Восстановленный НАД в дыхательной цепи окисляется НАДН-дегидрогеназой, содержащей железосерный белок (FeS) и ФМН и прочно связанной с дыхательной цепью.
KoQ (убихинон), - служит коллектором восстановительных эквивалентов, поставляемых в дых цепь через флавиновые дегидрогеназы. Содержание его значит превосходит содержание других компонентов дыхательной цепи.
Дополнительным участником дых цепи явл FeS. Он участвует в окислительно-восстановительном процессе, протекающем по одноэлектронному типу. Первый участок локализации FeS находится между ФМН и KoQ, второй - между цитохромами b и c1. Это соотв тому факту, что со стадии ФМН путь протонов и электронов разделяется: первые накапливаются в митохондриальном матриксе, а вторые идут на гидрофобные переносчики - KoQ и цитохромы.
Цитохромы в дых цепи выстроены в порядке возрастания окислит-восст-льного потенциала. Они предст собой гемопротеины, в которых простетическая геминовая группа близка к гему гемоглобина (у цитохрома b идентична). Ионы железа в сост гема при получении и отдаче электронов обратимо изменяют свою валентность.
В процессах тканевого дыхания наиболее важную роль играют цитохро-мы b, с1, с, а и а3. Цитохром а3 представляет собой терминальный участок дыхательной цепи – цитохромоксидазу, которая осуществляет окисление цитохрома с и образование воды. Элементарный акт представляет собой двухэлектронное восстановление одного атома кислорода, т.е. каждая молекула кислорода одновременно взаимодействует с двумя электрон-транспортными цепями. При транспорте каждой пары электронов во внутримитохондриальном пространстве может накапливаться до 6 протонов.
Окислительное фосфорилирование и дыхательный контроль. Функция дых цепи – утилизация восст-ных дых переносчиков, обр-щихся в р-циях метаболич окисления субстратов (гл.об. в ЦТК). Каждая окислительная реакция в соответствии с величиной высвобождаемой энергии «обслуживается» соответствующим дыхательным переносчиком: НАДФ, НАД или ФАД. Соответственно своим окисл-но-восст-ным потенциалам эти соединения в восстановленной форме подключаются к дыхательной цепи. В дыхательной цепи происходит дискриминация протонов и электронов: в то время как протоны переносятся через мембрану, создавая ΔрН, электроны движутся по цепи переносчиков от убихинола к цитохромоксидазе, генерируя разность электрических потенциалов, необходимую для обр-ния АТФ протонной АТФ-синтазой. Т.об., тканевое дыхание «заряжает» митохондр мембрану, а окислит фосфорилирование «разряжает» ее.
Обычно в тканях восстановленный НАДФ используется в пластическом обмене, обеспечивая разнообразные синтетические процессы, так что равновесие трансгидрогеназной реакции сильно сдвинуто влево.
Эффективность окислительного фосфорилирования в митохондриях определяется как отношение величины образовавшегося АТФ к поглощенному кислороду: АТФ/О или Р/О (коэффициент фосфорилирования). Экспериментально определяемые значения Р/О, как правило, оказываются меньше 3. Это свидетельствует о том, что процесс дыхания не полностью сопряжен с фосфорилированием. Действительно, окислительное фосфорилирование в отличие от субстратного не является процессом, в котором окисление жестко сопряжено с образованием макроэргов. Степень сопряжения зависит главным образом от целостности митохондриальной мембраны, сберегающей разность потенциалов, создаваемую транспортом электронов. По этой причине соединения, обеспечивающие протонную проводимость (как 2,4-ди-нитрофенол), являются разобщителями.
Билет 6
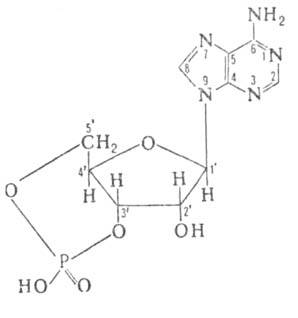
1-циклические аденозинмонофосфаты,стр-ра функции
цАМФ
(аденозин-3',5'-циклофосфат; 3',5'-АМФ), мол.
м. 329,22; б/цв. кристаллы;![]() — 51°; соли
Na, К и аммония
хорошо раств. в воде,
соли
Ag и двухвалентных металлов
в воде
практич не раств-тся.
— 51°; соли
Na, К и аммония
хорошо раств. в воде,
соли
Ag и двухвалентных металлов
в воде
практич не раств-тся.
Конфигурация
остатка рибозы
в цАМФ-С3-эндо-С4-экзо.
Циклофосфатное кольцо, конденсированное
с рибозным циклом, имеет конформацию
кресла. Кристаллич. ячейка состоит из
двух мол-л,
в одной из к-рых аденпновое основание
расположено в син-, а в другой-в
анти-конформации относительно рибозного
кольца. Последняя конформация
хар-рна также для мол-л
в р-ре.
цАМФ-вторичный мессенджер, т.е. осуществляет ф-ции внутриклеточного посредника в действии первичных мессенджеров-ряда гормонов и медиаторов (передатчиков) нервного возбуждения. Участвует также в регуляции обмена УГов и липидов, клеточного роста, мембранного транспорта и др. В бактериальных клетках цАМФ, вз-действуя со специфич. рецепторным белком, вызывает в нем конформационные изменения, в результате чего белок приобретает способность связываться с клеточной ДНК и регулировать активность генов. В клетках высших орг-мов цАМФ активирует ф-т протеинкиназу, к-рый катализирует перенос остатка фосфорной к-ты с АТФ на белок. Активация заключается в связывании цАМФ с регуляторной субъединицей ф-та, в результате чего освобождается активная каталитич. субъединица, к-рая и осуществляет р-цию. Протеинкиназа может катализировать фосфорилирование нек-рых ф-тов, а также ряда регуляторных и стр-рных белков, что приводит к изменению их св-в. Так, ф-т киназа фосфорилазы b фосфорилируется с обр-нием активной формы, к-рая сама в свою очередь катализирует фосфорилирование др. ф-та-фосфорилазы b. Последняя ускоряет распад гликогена в орг-ме.
цАМФ оказывает влияние и на дефосфорилирование белков, к-рое осуществляется под действием протеинфосфатаз. Так, Протеинкиназа фосфорилирует один из белков, в результате чего он приобретает св-ва ингибировать фосфата-зу1-ф-т, кат-ющий дефосфорилирование. Метаболизм цАМФ осуществляют два ф-та -аденил-атциклаза, кат-ющая синтез цАМФ из АТФ, и фосфодиэстераза цАМФ, к-рая катализирует гидролиз цАМФ по З'-фосфоэфирной связи с обр-нием 5'-аденозинмонофосфата.
2-сахароза, как влияет её строение на хим св-ва?может ли она восстонавливать аммиачный р-р Ag
Одним из наиболее распространенных дисахаридов явл сахароза – обычный пищевой сахар. Мол-ла сахарозы состоит из одного остатка D-глюкозы и одного остатка D-фруктозы. след , это α-глюко-пиранозил-(1–>2)-β-фруктофуранозид:
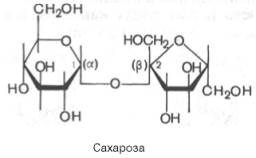
В отличие от большинства дисахаридов сахароза не имеет свободного полуацетального гидроксила и не обладает восстанавливающими св-вами. Гидролиз сахарозы приводит к обр-нию смеси, к-рую называют инвертированным сахаром. В этой смеси преобладает сильно левовращающая фруктоза, к-рая инвертирует (меняет на обратный) знак вращения правовращающего раствора исходной сахарозы.
3-высшие ЖКы.числа омыления,йодное число и к-тное число
ВЖК , натуральные (природные) и синтетич. карбоновые к-ты алифатич. ряда с числом атомов углерода в мол-ле не менее 6.
Натуральные ВЖК - преим. одноосновные к-ты нормального строения с четным числом атомов углерода в мол-ле; м. б. насыщенными и ненасыщенными (с двойными связями, реже с тройными). Кроме карбоксильной группы, они могут содержать др. функц. группы, напр. ОН. Содержатся в животных жирах и растит. маслах в виде сложных эфиров глицерина (т. наз. глицеридов), а также в прир. восках в виде эфиров ВЖС наиб. распространены к-ты с 10-22 атомами углерода в мол-ле.
Получают натуральные ВЖК из жиров и масел. В промети используют преим. высокотемпературный (200-225 oС) гидролиз под давлением (~ 2,50 МПа), реже-к-тный гидролиз в присут. контакта Петрова. В лаб. условиях ВЖК синтезируют к-тным гидролизом в присут. реактива Твитчеля (смесь олеиновой и серной к-т с бензолом), ф-тативным (липазным) гидролизом, омылением р-рами гидроксидов металлов I группы с послед. разложением образовавшихся солей (мыл) водными р-рами H2SO4 или НС1.
ИОДНОЕ ЧИСЛО, масса иода (в г), присоединяющегося к 100 г орг. в-ва. Хар-ризует степень ненасыщенности орг. Соединений.
К-ТНОЕ
ЧИСЛО,
масса КОН (в мг), необходимая для
нейтрализации
1 г орг. в-ва. Хар-ризует содержание в
в-ве своб. к-т. Равно разности м/у числом
омыления
и эфирным
числом.
Определяют по ф-ле:
![]() где
V-объем (в мл) 0,1 н спиртового р-ра КОН,
пошедшего на титрование,
о-навеска в-ва (в г). При определении
к-тного числа восков
и смол в качестве р-рителя используют
смесь ксилола
(бензола)
и абс. спирта.
На основании
к-тного числа может быть определена
мол. масса к-ты или средняя мол. масса
смеси к-т по ф-ле М = 56104: к-тное число.
Применяют к-тное число при анализе
жиров,
восков,
эфирных
масел
и др.
где
V-объем (в мл) 0,1 н спиртового р-ра КОН,
пошедшего на титрование,
о-навеска в-ва (в г). При определении
к-тного числа восков
и смол в качестве р-рителя используют
смесь ксилола
(бензола)
и абс. спирта.
На основании
к-тного числа может быть определена
мол. масса к-ты или средняя мол. масса
смеси к-т по ф-ле М = 56104: к-тное число.
Применяют к-тное число при анализе
жиров,
восков,
эфирных
масел
и др.
ОМЫЛЕНИЯ ЧИСЛО, масса КОН (в мг), необходимая для взаимод. со своб. к-тами и сложными эфирами, содержащимися в 1 г орг. в-ва. Равно сумме к-тного и эфирного чисел. Для определения омыления числа анализируемое в-во кипятят со спиртовым р-ром КОН; избыток щелочи оттит-ровывают р-ром НСl. При этом омыления число равно 28,05 (V2 — V1)/a, где V2 и V1,-объемы (в мл) 0,5 н. р-ра НСl, пошедшие на титрование соотв. в холостом опыте и в опыте с пробой, а-навеска в-ва (в г). Для животных жиров, напр., омыления число составляет 170-260, для растит. масел-170-200, для пчелиного воска-88-103.
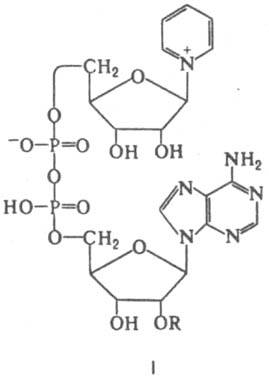
4-важнейшие коф-ты НАД и НАДФ..их стр-ры..функции
КОФЕРМEНТЫ
Никотинамидные
коф-ты
- коф-тная форма вит-а
ниацина.
К этой группе коф-тов, универсальных по
распространению (они найдены буквально
во всех живых клетках)
и биол.
роли, относятся НАД (ф-ла I; R=Н) и
никотинамидадениндинуклеотидфосфат,
или НАДФ [I; R=РО(ОН)2],
а также восстановленные (по пиридиновому
кольцу) формы этих соед. (соотв. НАДН и
НАДФН). наиб. важная биохим. ф-ция этих
коф-тов - их участие в переносе электронов
и водорода
от окисляющихся субстратов
 к
кислороду
в клеточном дыхании.
При участии НАД или НАДФ, связанных
прочно или легко диссоциирующих, ф-ты
дегидрогеназы
(напр., алкогольдегидрогеназа,
глутаматдегидрогеназа)
катализируют обратимое превращ. спиртов,
гидроксик-т
и нек-рых АМК
в соотв-ующие альдегиды,
кетоны
или кеток-ты..
стадий, включающих обр-ние радикалов.
к
кислороду
в клеточном дыхании.
При участии НАД или НАДФ, связанных
прочно или легко диссоциирующих, ф-ты
дегидрогеназы
(напр., алкогольдегидрогеназа,
глутаматдегидрогеназа)
катализируют обратимое превращ. спиртов,
гидроксик-т
и нек-рых АМК
в соотв-ующие альдегиды,
кетоны
или кеток-ты..
стадий, включающих обр-ние радикалов.
5. ЛИАЗЫ, класс ф-тов, катал-щих р-ции, в результате к-рых происходит разрыв связи С—С, С—О, С—N или др., сопровождающийся обр-нием двойных связей, а также обратные р-ции – присоед-ния по двойным связям. Разрыв связи в этих р-циях не сопряжен с гидролизом или с окислит.-восстановит. превращениями. В тех случ, когда преобладающей явл р-ция присоед, ф-ты наз. синтазами (в отлич от синтетаз). П/кл лиаз сформир-ны по типу расщепляемой связи, подп/клы - по природе элиминируемой в результ р-ции мол-лы (СО2, Н2О или др.). Угл-угл лиазы катал-ют расщепл связи С—С. В этот п/кл входит обширная гр карбоксилиаз, катал-щих р-цию декарбоксилирования с элиминированием СО2, напр. оксалоацетатдекарбоксилаза, фосфоенолпируват-карбоксикиназа. Для мн. карбоксилиаз кофакторы, принимающие участие в электроф. катализе декарбоксилирования, - тиаминдифосфат и пиридоксаль-5'-фосфат. Карбоксилиазы играют важную роль во мн. превращениях в-в, напр. в проц гниения. Альдегид-лиазы, или алъдолазы, катал-ют альдольную конденсацию и обратную ей р-цию. Эти ф-ты играют важную роль в обмене УГов. Лиазы кеток-т (напр., изоцитратлиаза) катал-ют гл. обр. синтез ди- и трикарбоновых к-т из 2 и более фрагментов. Мн. из них играют важную роль в цикле трикарбоновых к-т и в глиоксилатном цикле. Углерод-кислород лиазы кат-ют р.-ции, протекающие с расщепл связи С—О. В этот п/кл входит гр гидролиаз, напр. фумарат-гидратаза и энолаза, кат-ющие соотв. обратимые р-ции гидратации фумаровой к-ты с обр-нием яблочной к-ты и фосфоенолпировиноградной к-ты с обр-нием 2-фосфо-D-глицерина. Ф-ты этой гр с кофактором пиридоксаль-5'-фосфатом кат-ют элиминирование - и -заместителей L-АМК и замещение -заместителей. Так, L-сериндегидратаза кат-ет превращ. L-серина (с участием Н2О) в пировиноградную к-ту, NH3 и Н2О. Ф-ты этой гр кат-ют также распад полисахаридов путем р-ции элиминирования. Углерод-азот лиазы катализируют расщепление связи С—N. Аммиак-лиазы, напр. аспартат - аммиак-лиаза, осущ-ют дезаминированис АМК, ведущее к обр-нию ненасыщ. соед-ий. Амидин-лиазы, наоборот, кат-ют аминирование, к-рое осущ-ется взаимод. ненасыщ. к-ты с АМКой, напр. аргинина с фумаровой (ф-т - аргининосукцинат-лиаза). Углерод-сера лиазы кат-ют расщепление связи С—S. У большинства ф-тов коф-т - пиридоксаль-5'-фосфат. Эти лиазы играют существ. роль в метаболизме серосодерж АМК. Фосфор-кислород лиазы кат-ют отщепление пирофосфорной к-ты от нуклеозидтрифосфатов. Сюда входят нуклеотидил-циклазы - аденилатциклаза и гуанилатциклаза. Ф-ты важны для регуляции клет акт-сти. Сущ-ет еще неск. п/кл лиаз , к-рые представлены небольшим кол-вом ф-тов. Сюда можно отнести углерод - галоген лиазы (напр., ДДТ-дихлоргидраза), феррохелатазу, кат-ющую присоединение ионов Fe к мол-ле гема, и др.
