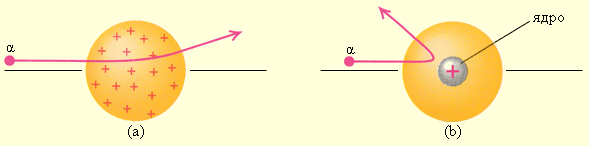- •3. Закрепление
- •Формулировка Общий случай
- •Случай трёхмерного пространства
- •Стационарное уравнение Шрёдингера
- •Получение уравнения Шрёдингера предельным переходом [источник не указан 57 дней]
- •Физический смысл волновой функции
- •Волновая функция в различных представлениях
- •Принцип суперпозиции квантовых состояний
- •Условия регулярности волновой функции
- •Нормированность волновой функции
- •Матричная и векторная формулировки
- •Философский смысл волновой функции
21) Как мы уже отметили во Введении к учебнику, в 8-м классе многие сведения нам придётся принять «на веру», так как в школе сложно проделать или описать соответствующие эксперименты. Причина – большинство из них объясняются «на стыке» ещё не изученных разделов физики и химии. Строение атомов и ионов – пример таких сведений. Познакомимся с ними.
|
|
Масса протона приблизительно равна массе нейтрона. По сравнению с их массами масса электрона пренебрежимо мала. Электроны относятся к так называемым отрицательно заряженным частицам, протоны – к положительно заряженным частицам. Нейтроны – к незаряженным или электронейтральным частицам (что такое электрический заряд и как определяются его знаки «+» и «–», мы узнаем в § 8-б).
|
|
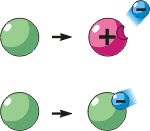
В результате переходов электронов образуются ионы – атомы или группы атомов, в которых число электронов не равно числу протонов. Если ион содержит отрицательно заряженных частиц больше, чем положительно заряженных, то такой ион называют отрицательным. В противоположном случае ион называют положительным. В верхней части рисунка показана потеря атомом электрона, то есть образование положительного иона. В нижней части рисунка – образование из атома отрицательного иона.
Ионы очень часто встречаются в веществах, например, они есть во всех без исключения металлах. Причина заключается в том, что один или несколько электронов от каждого атома металла отделяются и движутся внутри металла, образуя так называемый электронный газ. Именно из-за потери электронов, то есть отрицательных частиц, атомы металла становятся положительными ионами. Это справедливо для металлов в любом состоянии – твёрдом, жидком или газообразном (например, для паров ртути).
|
|
Ионы могут быть образованы несколькими атомами (группой атомов). Например, при растворении в воде серной кислоты каждая её молекула образует два иона водорода 2H+ и один ион кислотного остатка SO42-. Распад молекулы можно выразить уравнением: H2SO4 = 2H+ + SO42-.
Символ «2–» означает два дополнительных электрона, символ «+» означает один недостающий электрон. |
|
|
Образование ионов из нейтральных молекул (ионизация) может происходить по разным причинам. Одну из них, растворение, мы только что рассмотрели. Другая причина – повышение температуры. При этом увеличивается размах колебаний как молекул, так и атомов, входящих в их состав. Если температура превысит некоторое значение, то молекула распадётся, и образуются ионы. Ионизация может происходить и по другим причинам.
2) Первая попытка создания модели атома на основе накопленных экспериментальных данных (1903 г.) принадлежит Дж. Томсону. Он считал, что атом представляет собой электронейтральную систему шарообразной формы радиусом, примерно равным 10–10 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся внутри него (рис. 6.1.1). Для объяснения линейчатых спектров испускания атомов Томсон пытался определить расположение электронов в атоме и рассчитать частоты их колебаний около положений равновесия. Однако эти попытки не увенчались успехом. Через несколько лет в опытах великого английского физика Э. Резерфорда было доказано, что модель Томсона неверна.
|
Рисунок 6.1.1. Модель атома Дж. Томсона |
Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909–1911 годах. Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 107 м/с, но все же значительно меньше скорости света). α-частицы – это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома. Схема опыта Резерфорда представлена на рис. 6.1.2.
|
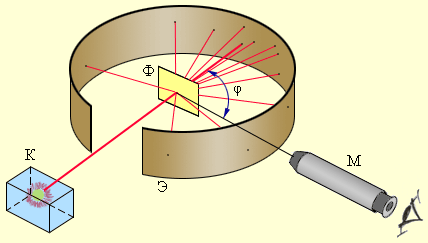
Рисунок 6.1.2. Схема опыта Резерфорда по рассеянию α-частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп |
От радиоактивного источника, заключенного в свинцовый контейнер, α-частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Этот результат был совершенно неожиданным даже для Резерфорда. Его представления находилbcm в резком противоречии с моделью атома Томсона, согласно которой положительный заряд распределен по всему объему атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α-частицы назад. Электрическое поле однородного заряженного шара максимально на его поверхности и убывает до нуля по мере приближения к центру шара. Если бы радиус шара, в котором сосредоточен весь положительный заряд атома, уменьшился в n раз, то максимальная сила отталкивания, действующая на α-частицу, по закону Кулона возросла бы в n2 раз. Следовательно, при достаточно большом значении n α-частицы могли бы испытать рассеяние на большие углы вплоть до 180°. Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома. Рис. 6.1.3 иллюстрирует рассеяние α-частицы в атоме Томсона и в атоме Резерфорда.
|
Рисунок 6.1.3. Рассеяние α-частицы в атоме Томсона (a) и в атоме Резерфорда (b) |
Таким образом, опыты Резерфорда и его сотрудников привели к выводу, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10–14–10–15 м. Это ядро занимает только 10–12 часть полного объема атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Веществу, составляющему ядро атома, следовало приписать колоссальную плотность порядка ρ ≈ 1015 г/см3. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома. Впоследствии удалось установить, что если заряд электрона принять за единицу, то заряд ядра в точности равен номеру данного элемента в таблице Менделеева.
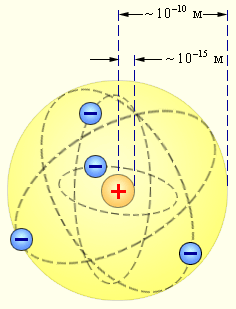
Радикальные выводы о строении атома, следовавшие из опытов Резерфорда, заставляли многих ученых сомневаться в их справедливости. Не был исключением и сам Резерфорд, опубликовавший результаты своих исследований только в 1911 г. через два года после выполнения первых экспериментов. Опираясь на классические представления о движении микрочастиц, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, под действием кулоновских сил со стороны ядра вращаются электроны (рис. 6.1.4). Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
|
Рисунок 6.1.4. Планетарная модель атома Резерфорда. Показаны круговые орбиты четырех электронов |
Планетарная модель атома, предложенная Резерфордом, несомненно явилась крупным шагом вперед в развитии знаний о строении атома. Она была совершенно необходимой для объяснения опытов по рассеянию α-частиц, однако оказалась неспособной объяснить сам факт длительного существования атома, т. е. его устойчивость. По законам классической электродинамики, движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию. За короткое время (порядка 10–8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.
22) ПОСТУЛАТЫ БОРА:::
Модель, предложенная Резерфордом, не позволила объяснить устойчивость атома. Ускоренное движение электрона согласно теории Максвелла сопровождается электромагнитным излучением, поэтому энергия электрона уменьшается, и он движется по спирали, приближаясь к ядру. Казалось бы, электрон должен упасть на ядро, так как при движении по спирали уменьшается энергия электрона. В действительности атомы являются устойчивыми системами. Выход из этого затруднения предложен Н.Бором. В основе его теории лежат следующие постулаты (Приложение 1):
1. Существуют особые, стационарные состояния атома, находясь в которых атом не излучает энергию, при этом электроны в атоме движутся с ускорением. Каждому стационарному состоянию соответствует определённая энергия Еn.
2. Излучение света происходит при переходе атома из стационарного состояния с большей энергией Ек в стационарное состояние с меньшей энергией Еn. Энергия излучённого фотона равна разности энергий стационарных состояний:
hvкn = Eк – En
Отсюда частоту излучения можно выразить так:
vкn = (Eк – En)/h = Eк/h – En/h
Согласно теории Бора энергия электрона в атоме водорода, находящегося на n-м энергетическом уровне, равна:
En = – (k2mee4) / 2ћ2n2, где
m – масса электрона, v – его скорость, r – радиус круговой орбиты, ћ – постоянная Планка, n – целое число, k = 9 ·109 Н·м2 / Кл2.
При поглощении света атом переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией (Приложение 2). Второй постулат, также как и первый, противоречит электродинамики Максвелла, так как согласно этому постулату частота излучения света свидетельствует не об особенностях движения электрона, а лишь об изменении энергии атома. Свои постулаты Бор применил для построения теории простейшей атомной системы – атома водорода. Основная задача состояла в нахождении частот электромагнитных волн, излучаемых водородом. Эти частоты можно найти на основе второго постулата и правила определения стационарных значений энергии атома. Это правило (так называемое правило квантования) Бору опять-таки пришлось постулировать.
Бор рассматривал простейшие круговые орбиты:
Wр = – е2 / r2, где
е – модуль заряда электрона; r – расстояние от электрона до ядра.
Согласно механике Ньютона полна энергия равна:
mv2 / 2 – e2 / r2.
Кулоновская сила сообщает электрону центростремительное ускорение:
mv2 / r = e2 / r2 или mrv2 = e2.
(произведение mrv называется моментом импульса электрона)
По классической механике радиус орбит может быть любым, следовательно, любые значения может принимать и энергия.
Е = – е2 / 2r.
По постулату Бора энергия может быть только определённого значения Еn.
При движении электрона по круговой орбите модуль его импульса mv и радиус остаются неизменными.
mvr – момент импульса. Это совпадает с постоянной Планка по наименованиям:
Дж · с = (кг · м / с ) · м.
Бор предположил, что mvr = nћ, где n = 1, 2, 3. Это и есть правило квантования:
mrv2
= e2 и mvr =
nћ,
mrv = nћ / 2![]() ,
,
где m – масса электрона, v – его скорость, r – радиус круговой орбиты, ћ – постоянная Планка (ћ = 6,625 · 10–34 Дж·с), n – целое число (главное квантовое число).
Получаем rn = ћn2 / me2.
Радиусы орбит меняются дискретно числам n.
Наименьшая орбита: r1 = 5 · 10–9 см.
Это и есть радиус атома. Теория Бора даёт для него правильное значение.
Вывод (Приложение 3): теория Бора приводит к количественному согласию с экспериментом для значений этих частот. Все частоты излучений атома водорода составляют в своей совокупности ряд серий, каждая из которых образуется при переходах атома в одно из энергетических состояний со всех верхних энергетических состояний (состояний с большей энергией). Переходы в первое возбуждённое состояние (на второй энергетический уровень) с верхних уровней образуют серию Бальмера. Данная серия названа по имени швейцарского учителя И.Бальмера, который ещё в 1885 г. на основе экспериментальных данных вывел простую формулу для определения частот видимой части спектра водорода.
Поглощение света – процесс, обратный излучению. Атом, поглощая свет, переходит из низших энергетических состояний в высшие. При этом он поглощает излучение той же самой частоты, которую излучает, переходя из высших энергетических состояний в низшие. Однако построить количественную теорию для следующего за водородом атома гелия на основе боровских представлений не удалось. Это неудивительно, так как теория Бора была половинчатой. С одной стороны, используется закон Кулона и механика Ньютона, а с другой – вводятся квантовые постулаты. Введение в физику квантовых представлений требовало радикальной перестройки механики и электродинамики. Эта перестройка была осуществлена, когда были созданы новые физические теории: квантовая механика и квантовая электродинамика. Постулаты Бора оказались совершенно правильными. Правило же квантования Бора, как выяснилось, применимо далеко не всегда.
3. Закрепление
В конце урока повторяется и углубляется изученное (Приложение 4). Для этого можно разобрать с учащимися диаграммы энергетических уровней атома водорода. Важно подчеркнуть, что эта диаграмма рассчитана в современной теории и проверена с помощью измерений на опыте. Разъясняется, что в низшем энергетическом состоянии электрон может находиться сколь угодно долго, не излучая энергию вопреки законам классической физики. Поглотить же энергию он может – при этом перейдёт в одно из изображённых на диаграмме возбуждённых состояний. Следует рассчитывать (в эВ) энергию, которую нужно сообщить атому для таких переходов.
23):::: Опыт Франка-Герца. Недостатки теории Бора
Перейти к: навигация, поиск
![]()
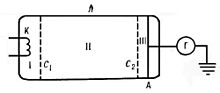
Схема электровакуумной трубки, использованной в эксперименте
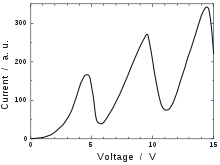
Зависимость тока от напряжения. Видны острые периодические пики, соответствующие ионизации атомов.
Опыт Франка — Герца — опыт, явившийся экспериментальным доказательством дискретности внутренней энергии атома. Поставлен в 1913 Дж. Франком и Г. Герцем.
На рисунке приведена схема опыта. К катоду К и сетке C1 электровакуумной трубки, наполненной парами Hg (ртути), прикладывается разность потенциалов V, ускоряющая электроны, и снимается зависимость силы тока I от V. К сетке C2 и аноду А прикладывается замедляющая разность потенциалов. Ускоренные в области I электроны испытывают соударения с атомами Hg в области II. Если энергия электронов после соударения достаточна для преодоления замедляющего потенциала в области III, то они попадут на анод. Следовательно, показания гальванометра Г зависят от потери электронами энергии при ударе.
В опыте наблюдался монотонный рост I при увеличении ускоряющего потенциала вплоть до 4,9 В, то есть электроны с энергией Е < 4,9 эВ испытывали упругие соударения с атомами Hg и внутренняя энергия атомов не менялась. При значении V = 4,9 В (и кратных ему значениях 9,8 В, 14,7 В) появлялись резкие спады тока. Это определённым образом указывало на то, что при этих значениях V соударения электронов с атомами носят неупругий характер, то есть энергия электронов достаточна для возбуждения атомов Hg. При кратных 4,9 эв значениях энергии электроны могут испытывать неупругие столкновения несколько раз.
Таким образом, опыт Франка — Герца показал, что спектр поглощаемой атомом энергии не непрерывен, а дискретен, минимальная порция (квант электро-магнитного поля), которую может поглотить атом Hg, равна 4,9 эВ. Значение длины волны λ = 253,7 нм свечения паров Hg, возникавшее при V > 4,9 В, оказалось в соответствии со вторым постулатом Бора
![]() ,
,
где E0 и E1 — энергии основного и возбужденного уровней энергии. В опыте Франка — Герца, E0 — E1 = 4,9 эв.
Артур Комптон, повторив (1922—1923) опыт Франка — Герца, обнаружил, что при V > 4,9 В пары Hg начинают испускать свет с частотой ν = ΔE/h, где ΔE = 4,9 эВ (h — постоянная Планка). Таким образом, возбуждённые электронным ударом атомы Hg испускают фотон с энергией 4,9 эВ и возвращаются в основное состояние.
В 1925 г. Густав Герц и Джеймс Франк были награждены Нобелевской премией за открытие законов соударения электрона с атомом.
24) Уравне́ние Шрёдингера — уравнение, описывающее изменение в пространстве и во времени чистого состояния, задаваемого волновой функцией, в гамильтоновых квантовых системах. Играет в квантовой механике такую же важную роль, как уравнение второго закона Ньютона в классической механике. Его можно назвать уравнением движения квантовой частицы. Установлено Эрвином Шрёдингером в 1926 году.
Уравнение Шрёдингера предназначено для частиц без спина, движущихся со скоростями много меньшими скорости света. В случае быстрых частиц и частиц со спином используются его обобщения (уравнение Клейна — Гордона, уравнение Паули, уравнение Дирака и др.)
В начале XX века учёные пришли к выводу, что между предсказаниями классической теории и экспериментальными данными об атомной структуре существует ряд расхождений. Открытие уравнения Шрёдингера последовало за революционным предположением де Бройля, что не только свету, но и вообще любым телам (в том числе и любым микрочастицам) присущи волновые свойства.
Исторически окончательной формулировке уравнения Шрёдингера предшествовал длительный период развития физики. Оно является одним из фундаментальных законов физики, объясняющих физические явления. Квантовая теория, однако, не требует полного отказа от законов Ньютона, а лишь определяет границы применимости классической физики. Следовательно, уравнение Шрёдингера должно согласовываться с законами Ньютона в предельном случае. Это подтверждается при более глубоком анализе теории: если размер и масса тела становятся макроскопическими и точность слежения за его координатой много хуже стандартного квантового предела, прогнозы квантовой и классической теорий совпадают, потому что неопределённый путь объекта становится близким к однозначной траектории.
Содержание
|