
- •«Физическая химия»
- •Энтальпия (Теплосодержание).
- •Стандартные теплоты образования и сгорания.
- •Зависимость теплоты процесса от температуры. (Уравнения Кирхгоффа)
- •Цикл карно.
- •II закон термодинамики.
- •Энтропия в случае неравновесных процессов.
- •Вычисление энтропии. Постулат планка.
- •Энтропия идеального твердого тела
- •Энтропия жидкого вещества
- •Энтропия газа при некоторой т
- •Изохорно-изотермический потенциал (Изохорный потенциал, свободная энергия, энергия Гельмгольца)
- •Изобарно – изотермический потенциал (Изобарный потенциал, энергия Гиббса, свободная энергия при постоянном давлении)
- •Термодинамические потенциалы.
- •Уравнения максимальной работы (уравнения Гиббса-Гельмгольца).
- •Статистический характер II закона термодинамики.
- •При малых и р функция может быть разложена в ряд Маклорена; ограничимся двумя членами ряда:
- •Фазовые переходы первого рода.
- •Если насыщенный пар можно считать идеальным газом, тогда
- •Фазовые переходы второго рода.
- •Зависимость давления насыщенного пара от температуры.
- •Закон смещения равновесия (правило подвижного равновесия)
Энтропия идеального твердого тела
![]() =
=
![]() ; ST
So
=
; ST
So
=
![]()
ST
=
![]()
Для расчета величины ST надо знать зависимость СР от Т, причем определенную до возможно более низких Т (до 10 К или, в крайнем случае, до 80 К). Значение СР при 0 К находят путем экстраполяции или с помощью эмпирических приемов.
Энтропия жидкого вещества
ST
=
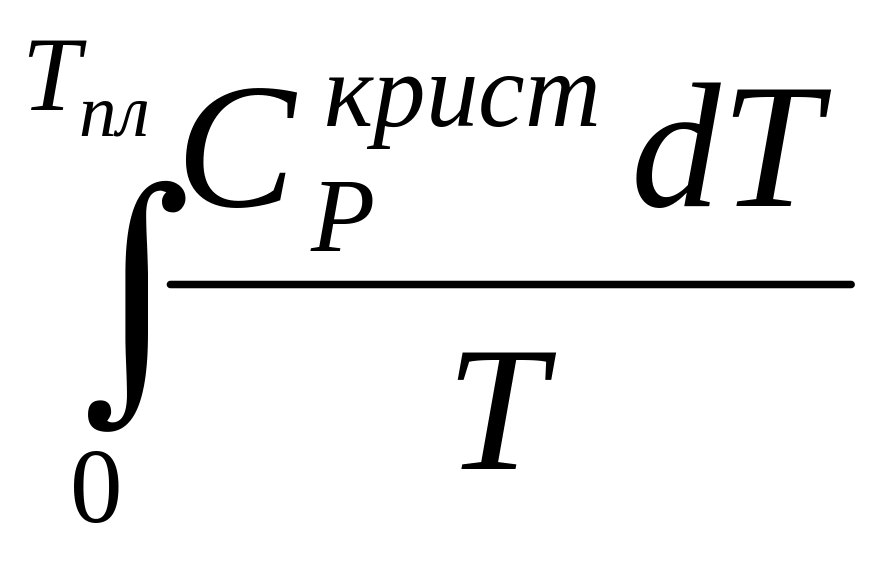 +
+
![]() +
+
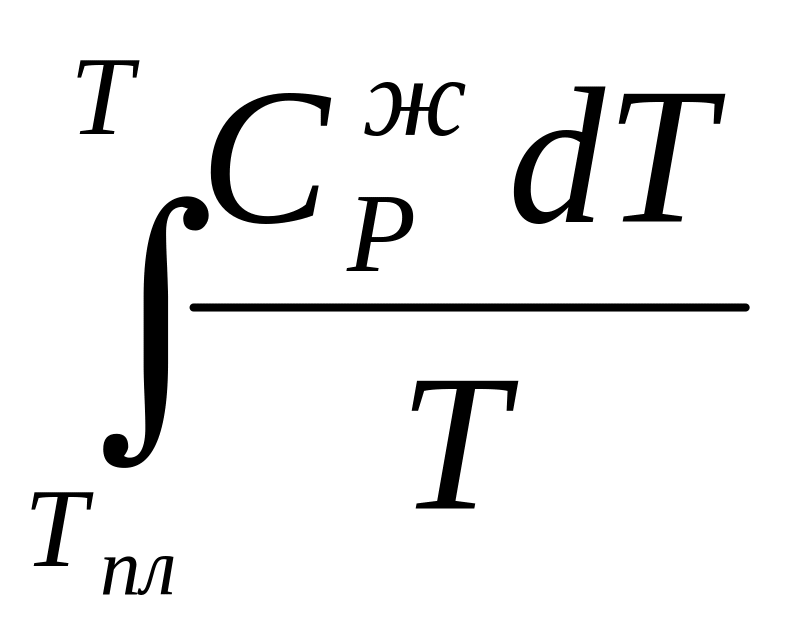
Энтропия газа при некоторой т
ST
=
+
+
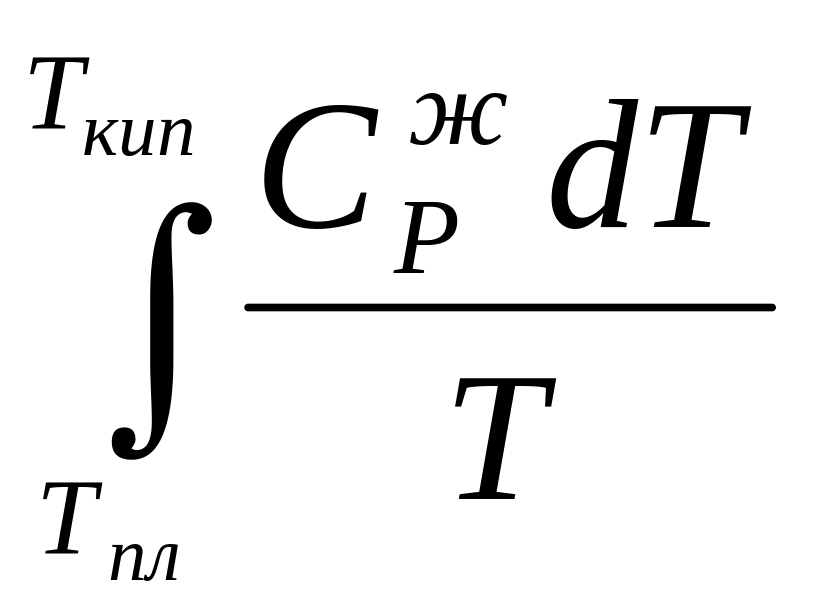 +
+
![]() +
+
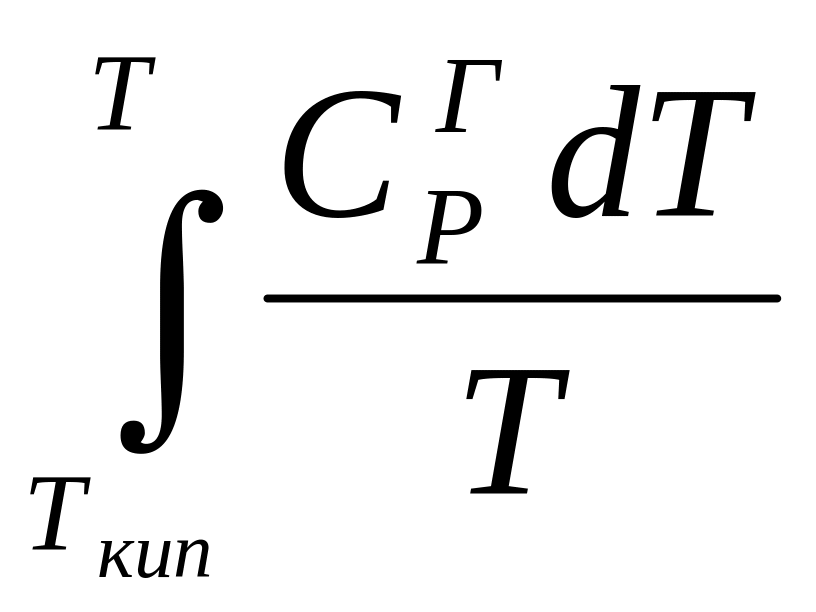
По этой формуле можно вычислить энтропию реального газа при температуре Т и Р = 1 атм (если испарение проводилось при нормальной Т кипения).
Когда вещество в твердом состоянии имеет несколько модификаций, в уравнения добавятся соответствующие члены (нагревание и фазовый переход).
Интегральные члены уравнения находят графическим интегрированием : строят кривые СР/Т = f (Т) и значение интеграла находят по площади.
Абсолютные значения энтропии, рассчитанные для стандартных условий (Р = 1 атм, Т = 298 К), называются стандартными значениями энтропии So298.
Лекция 6
Характеристические функции. Общие условия равновесия.
Энтропия критерий оценки направления процесса (самопроизвольного протекания процесса) и достижения равновесия в изолированных системах. Для разбора изотермических процессов мы должны применять другие критерии.
Изохорно-изотермический потенциал (Изохорный потенциал, свободная энергия, энергия Гельмгольца)
Q = dU + A TdS
A TdS dU ; T = const
A T (S2 S1) (U2 U1) , A (U1 TS1) (U2 TS2)
U TS = F F = U - TS
F свободная энергия системы; F функция состояния системы, т.к. U, T, S тоже функции.
A F1 F2 ; A F
В равновесных процессах A = F (равна убыли F) работа равновесного процесса (максимальная работа) не зависит от пути, а определяется лишь начальным и конечным состояниями системы.
U = F + TS
U можно рассматривать как состоящую из двух частей свободной энергии F и связанной энергии TS : лишь часть внутренней энергии (свободная энергия F, которую система отдает вовне при T = const) может превратиться в работу. Другая часть внутренней энергии связанная энергия при изменении системы при T = const не дает работы, а переходит только в теплоту :
TS = K ; dK = TdS + SdT ; SdT = 0
dK = TdS ; K = TS = Q
Для процессов, протекающих с изменением Т (Т const) деление «U» на свободную и связанную не может быть проведено и сами термины не имеют общего значения.
Экстенсивные и интенсивные параметры состояния системы:
Экстенсивные (емкостные) параметры зависят от количества вещества (от массы, V) : это m, V, CP, CV, S, U. Эти параметры обладают свойством аддитивности.
Интенсивные параметры от количества вещества не зависят, а определяются специфическим характером состояния системы. Это Т, Р, химический потенциал. Экстенсивные факторы, отнесенные к единице массы (объема) становятся интенсивными (плотность вещества , Vуд).
S обладает свойством аддитивности (S всей системы равна сумме S частей системы). S фактор емкости связанной энергии.
Изохорный потенциал есть функция V и Т :
1. Равновесные процессы : F = U – TS
dF = dU – TdS – SdT , dU = TdS – A
dF = TdS – A – TdS – SdT
dF = – PdV – SdT , F = F(V,T)
– это полный дифференциал функции от V,T.
dF
=
![]() dV
+
dV
+
![]() dT
;
= – P ,
= – S
dT
;
= – P ,
= – S
P – мера убыли F с ростом V при T = const
S – мера убыли F с ростом Т при V = const
2. Неравновесные процессы
dU TdS – A , dF TdS – PdV – TdS – SdT
dF – PdV – SdT
Если V = const и T = const и отсутствуют другие виды работы :
(F)V,T 0
т.е. изохорный потенциал системы, находящейся при V,T = const, не изменяется при равновесных процессах и убывает при неравновесных процессах. Иначе: изохорный потенциал системы, находящейся при V,T = const, стремится уменьшиться в естественных (самопроизвольных) процессах; когда он достигнет минимального значения, система приходит в равновесие.
(F)V,T 0 – критерий направления процесса в системе, находящейся при T,V = const;
(F)V,T = 0 , ( 2F)V,T 0 – критерий равновесия.
Все вышесказанное справедливо, если нет других видов работы, кроме работы расширения.
