- •«Физическая химия»
- •Энтальпия (Теплосодержание).
- •Стандартные теплоты образования и сгорания.
- •Зависимость теплоты процесса от температуры. (Уравнения Кирхгоффа)
- •Цикл карно.
- •II закон термодинамики.
- •Энтропия в случае неравновесных процессов.
- •Вычисление энтропии. Постулат планка.
- •Энтропия идеального твердого тела
- •Энтропия жидкого вещества
- •Энтропия газа при некоторой т
- •Изохорно-изотермический потенциал (Изохорный потенциал, свободная энергия, энергия Гельмгольца)
- •Изобарно – изотермический потенциал (Изобарный потенциал, энергия Гиббса, свободная энергия при постоянном давлении)
- •Термодинамические потенциалы.
- •Уравнения максимальной работы (уравнения Гиббса-Гельмгольца).
- •Статистический характер II закона термодинамики.
- •При малых и р функция может быть разложена в ряд Маклорена; ограничимся двумя членами ряда:
- •Фазовые переходы первого рода.
- •Если насыщенный пар можно считать идеальным газом, тогда
- •Фазовые переходы второго рода.
- •Зависимость давления насыщенного пара от температуры.
- •Закон смещения равновесия (правило подвижного равновесия)
Если насыщенный пар можно считать идеальным газом, тогда
Нисп
= Т
,
![]() =
=
![]()
Давление насыщенного пара жидкости можно сравнительно легко и точно измерить в широком интервале Т; значительно труднее измерить Нисп. По вышеприведенному уравнению можно рассчитать Нисп , причем интервал температур должен быть небольшим, т.к. величина Нисп изменяется с ростом Т. Более точно
|
Нисп вычисляют по значению dP/dT, которое находят, определив наклон касательной к опытной кривой Р = f (Т) пр заданной Т.
Зависимость Нисп от Т: убывает с ростом Т, не сильно изменяясь при средних Т и очень сильно – вблизи Ткр, при которой Нисп становится равной нулю. |
Нисп различных жидкостей закономерно связаны с их нормальными температурами кипения:
1.
Правило
Трутона:
Sисп
=
![]()
20 – 22
20 – 22
![]() –
–
мольные энтропии испарения различных жидкостей в нормальных точках кипения одинаковы.
2. Уравнение Кистяковского (более точное):
Sисп = = 8,75 + 4,57 ln Ткип ( )
3. Правило Гильдебранда – аналогично правилу Трутона, но выполняется более точно: Sисп жидкостей равны между собой при температурах, для которых мольные объемы насыщенного пара одинаковы, при этом Sисп = 20 – 22 при Vг = 49,5 л/моль.
Эти правила не выполняются в отношении многих веществ, например, ассоциированных жидкостей (вода, аммиак, спирты), а приблизительно выполняются для углеводородов и их производных, эфиров и других классов неполярных веществ.
Фазовые переходы второго рода.
Для них характерно не только равенство изобарных потенциалов, но и равенство энтропии и объемов сосуществующих в равновесии фаз, т.е. отсутствие теплового эффекта процесса и изменения объема при Т превращения:
G = S = V = 0
Но меняются скачкообразно некоторые другие параметры, например, СР.
Примеры фазовых переходов второго рода:
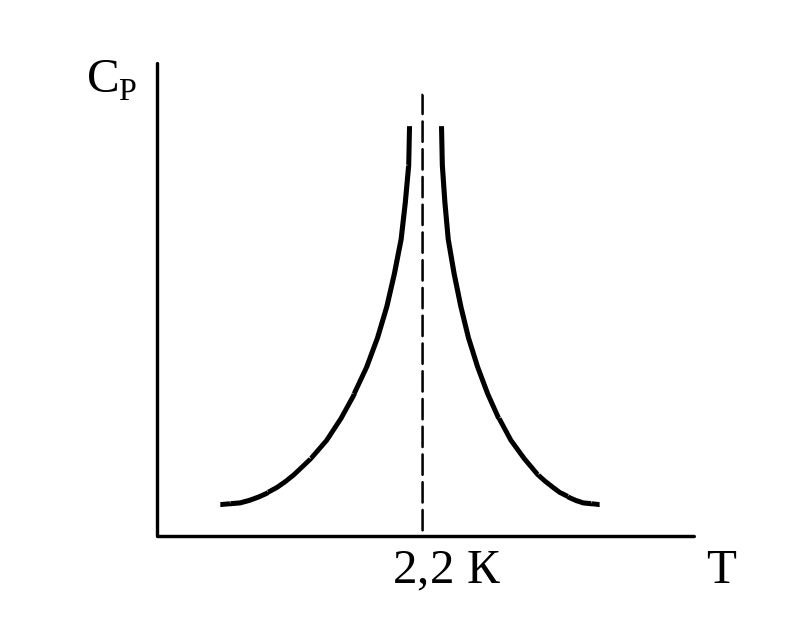
1. Скачкообразное изменение СР при превращении двух модификаций жидкого гелия при 2,2 К.
|
В некотором интервале Т вещество поглощает значительно большее количество теплоты, чем то, которое соответствовало бы кривой при отсутствии пика. Эта дополнительная теплота связана с превращением 2-го рода, но она поглощается в некотором интервале Т и вызывает аномальное увеличение СР в этом интервале; при Т максимума кривой теплота не поглощается. |
2. Превращения ферромагнитных тел при Т, называемой точкой Кюри, выше которой тела теряют ферромагнитные свойства.
Превращения обычных металлов в сверхпроводники при низких Т.
Процессы распада и образования интерметаллидов в твердых металлических растворах.
Зависимость давления насыщенного пара от температуры.
Давление насыщенного пара жидкости резко увеличивается с ростом Т; эта зависимость дается уравнением:
dP =
![]() dT ,
dT ,
а вдали от критической Т: d ln P = dT
Если интервал температур небольшой и Нисп можно считать постоянной, то
 =
=
![]()
![]() , ln
=
(
, ln
=
(![]() –
–
![]() )
=
)
=
![]()
Мы получили уравнение для расчета Нисп , зная Р2 при Т2 и Р1 при Т1.
Представим в виде неопределенного интеграла:
ln
P = –
![]() + const =
+ B
+ const =
+ B
Это – уравнение прямой в координатах ln P – 1/Т. Нисп можно найти по графику:
|
tg = A = – Нисп / R Вышеприведенные формулы справедливы для узкого интервала температур, далеких от критической: во-первых, Нисп зависит от Т; во-вторых, насыщенный пар при высоких Т нельзя считать идеальным газом. Поэтому уравнение, охватывающее зависимость Р = f (T) в широком интервале Т, неизбежно становится эмпирическим. |
Такое уравнение может быть получено путем применения уравнения Кирхгоффа к процессу парообразования.
![]() = Cнас. п. – Сж
СР
= Cнас. п. – Сж
СР
(Cнас. п. Можно заменить на СР при не очень высоких Р).
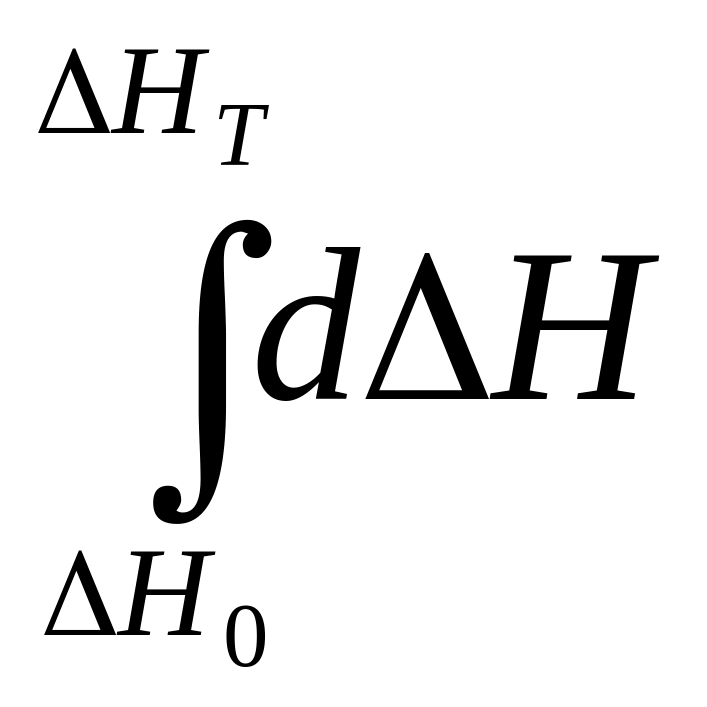 =
=
![]() , НТ = Но
+
, НТ = Но
+
(Но – теплота испарения при 0 К). Подставим вышеприведенное уравнение в уравнение: d ln P = dT
d ln
P =
![]() dT +
dT +

ln
P = –
![]() +
+
![]()
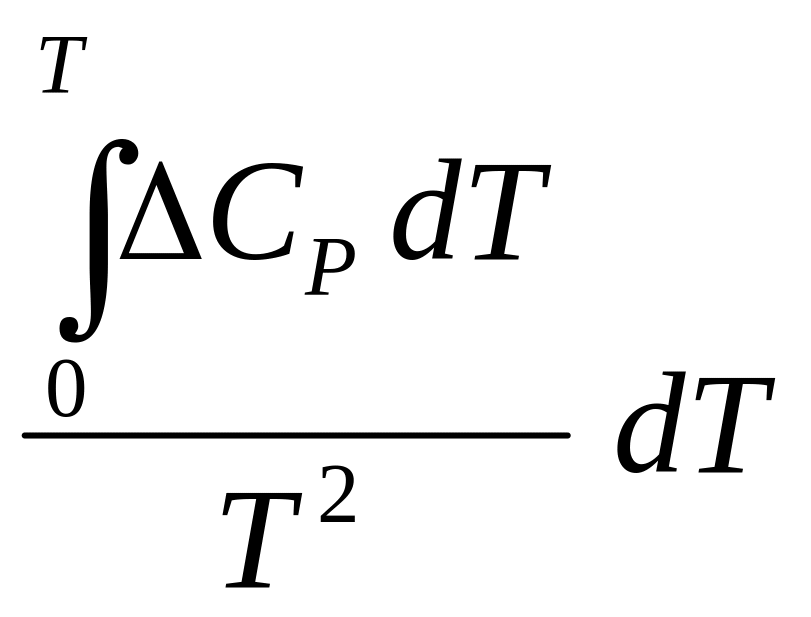 + j
+ j
j – постоянная интегрирования. Но и j могут принимать различные значения в зависимости от точности используемых данных по СР. Если СР известно точно и в широком интервале Т (что выполняется редко), то j определяется однозначно и называется истинной химической постоянной.
НТ = Но + aT + bT2 + cT3 + …
Подставим это выражение в то же самое уравнение:
d ln
P =
dT +
![]() dT
+
dT
+
![]() dT
+
dT
+
![]() dT
+ …
dT
+ …
ln
P = –
+
![]() lnT
+
T
+
lnT
+
T
+
![]() + … + const
+ … + const
lg
P = –
![]()
![]() +
+
![]() lgT
+
lgT
+
![]() T
+ … + const
T
+ … + const
(const = const /2,303 – переход от ln к lg; такие числовые значения получаются, если R выражено в калориях). Это уравнение было приведено Нернстом; он его упростил: = 1,75 ; b = –
lg P
= –
+ 1,75 lgT
–
![]() T
+ i
T
+ i
i – условная химическая постоянная. Величины Но , и i подбираются эмпирически; это менее точное уравнение, чем уравнение, в которое входит j. Величина i для многих веществ с двух- и многоатомными молекулами 3 (если Р – в атм).
Кривые давления насыщенного пара можно экстраполировать к высоким Р и Т методами сравнительного расчета. Эти методы основаны на подобии кривых, выражающих зависимость давления пара жидкостей от Т (особенно жидкостей, близких по химическим свойствам и Ткип). За стандартную выбирается одна из жидкостей (например, вода), давление пара которой хорошо изучено.