
- •«Физическая химия»
- •Энтальпия (Теплосодержание).
- •Стандартные теплоты образования и сгорания.
- •Зависимость теплоты процесса от температуры. (Уравнения Кирхгоффа)
- •Цикл карно.
- •II закон термодинамики.
- •Энтропия в случае неравновесных процессов.
- •Вычисление энтропии. Постулат планка.
- •Энтропия идеального твердого тела
- •Энтропия жидкого вещества
- •Энтропия газа при некоторой т
- •Изохорно-изотермический потенциал (Изохорный потенциал, свободная энергия, энергия Гельмгольца)
- •Изобарно – изотермический потенциал (Изобарный потенциал, энергия Гиббса, свободная энергия при постоянном давлении)
- •Термодинамические потенциалы.
- •Уравнения максимальной работы (уравнения Гиббса-Гельмгольца).
- •Статистический характер II закона термодинамики.
- •При малых и р функция может быть разложена в ряд Маклорена; ограничимся двумя членами ряда:
- •Фазовые переходы первого рода.
- •Если насыщенный пар можно считать идеальным газом, тогда
- •Фазовые переходы второго рода.
- •Зависимость давления насыщенного пара от температуры.
- •Закон смещения равновесия (правило подвижного равновесия)
Зависимость теплоты процесса от температуры. (Уравнения Кирхгоффа)
Рассмотренные выше теплоты химических реакций являются теплотами изотермических процессов и зависят от Т.
QV = U = U2 U1 ; QP = H = H2 H1
Продифференцируем эти равенства по Т при V (P) = const :
![]() =
=
![]()
![]() = CV,2
CV,1
= CV
= CV,2
CV,1
= CV
CV,2 мольная теплоемкость при V = const всей массы продуктов реакции
CV,1 всей массы исходных веществ
![]() =
=
![]()
![]() = CP,2
CP,1
= CР
= CP,2
CP,1
= CР
CV,2
CV,1
=
![]() nкCV,к
nкCV,к
![]() nнСV,н
=
nнСV,н
=
![]() niCV,i
niCV,i
CP,2 CP,1 = nкCP,к nнСP,н = niCP,i
Уравнения Кирхгоффа дают зависимость теплоты химической реакции от Т. Дифференциальная форма записи уравнений :
![]() =
=
![]() =
niCV,i
;
=
=
niCV,i
;
=
![]() =
niCP,i
=
niCP,i
Для
расчетов теплот реакций уравнения
должны быть проинтегрированы :
![]() =
=
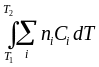 ,
,
![]() =
=
![]() +
=
+
+
=
+
![]() (Т2
Т1)
(Т2
Т1)
(Если интервал температур небольшой десятки градусов то С от Т практически не зависит и можно считать постоянной величиной).
Если Т изменяется в широком интервале, то Сi const и для интегрирования надо знать зависимость С от Т. В широком интервале Т (не слишком низких выше 200 К) зависимости С чистых веществ от Т могут быть выражены эмпирическими степенными рядами :
СР = a + bT + cT2 + ... (для оргaнических веществ)
СР = a + bT + cT-2 (для неорганических веществ)
СР = a + bT + cT-1/2
Интегральная форма записи уравнений Кирхгоффа :
НТ
= Но
+
![]() , НТ
= Н298
+
, НТ
= Н298
+
![]()
Лекция 4
II закон термодинамики. Равновесные и неравновесные, обратимые и необратимые, самопроизвольные и несамопроизвольные процессы. Постулаты Клаузиуса и Томсона. Цикл Карно.
Равновесные и неравновесные, обратимые и необратимые, самопроизвольные и несамопроизвольные процессы.
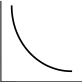
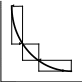

Р Р Р


V V V
(а) (б) (в)
Рис. (а), (б), (в) графики изотермического расширения идеального газа, находящегося в сосуде под давлением (см. лекцию 1); внешнее давление многократно ступенчато уменьшается. Рис. (а) : точки на кривой точки состояния равновесия. Рис. (б) : процесс протекает между теми же исходным и конечным состоянием, но скачки P и V здесь меньше, чем на рис. (а); кривые прямого и обратного процессов сблизились, число равновесных остановок возросло.
Изменяя давление последовательно и многократно на бесконечно малую величину, мы можем провести процесс так, что система будет находиться в каждый момент времени бесконечно близко к равновесию. Тогда кривые прямого и обратного процесса станут бесконечно близко друг к другу и к равновесной кривой, заключенной между ними. В этом процессе работа расширения, совершаемая системой, будет наибольшей. Такой процесс будет протекать бесконечно медленно, т.к. число скачков будет бесконечно велико, а время, необходимое для совершения одного скачка, конечно.
Рис. (в) : процесс проходит в прямом и обратном направлении через одни и те же состояния, бесконечно близкие к равновесию; этот процесс называется равновесным. Работа равновесного процесса имеет максимальную величину по сравнению с неравновесными процессами (рис. а и б) и называется максимальной работой.
Если равновесный процесс протекает в прямом, а затем в обратном направлении так, что не только система, но и окружающая среда возвращается в исходное состояние и в результате процесса не остается никаких изменений во всех участвовавших в процессе телах, то процесс называется обратимым. Иногда равновесный процесс называют обратимым изменением системы.
Равновесный процесс предельный тип процесса, абстракция; реальные физические и химические процессы всегда в большей или меньшей степени неравновесны. Само понятие «равновесный процесс» противоречиво : равновесие и процесс. Термодинамика вынуждена использовать в своих теоретических исследованиях понятие равновесных процессов, особенно в связи со II ЗТ. I ЗТ в форме его основных уравнений приложим в равной мере и к равновесным, и к неравновесным процессам, однако расчеты по I ЗТ во многих случаях могут быть количественно проведены только для равновесных процессов (вычисление работы).
Пример равновесных процессов идеальные механические процессы, протекающие без трения. Примеры крайних случаев неравновесных процессов : переход теплоты от тела с большей Т к телу с меньшей Т; переход механической работы в теплоту при трении; расширение газов в пустоту; самопроизвольное смешение газов или жидкостей путем диффузии; взрыв смеси горючего с окислителем. Эти процессы не могут быть проведены в обратном направлении через те же промежуточные состояния, что и прямые процессы. Неравновесные процессы протекают с конечной, иногда большой, скоростью; при этом система, являющаяся неравновесной, изменяясь, приближается к равновесию. С наступлением равновесия (сравниваются Т тел, газы и жидкости смешаются ...) процесс заканчивается.
Очевидно, что все неравновесные процессы протекают в направлении достижения равновесия и протекают «сами собой», т.е. без воздействия внешней силы. Очевидно также, что обратные по направлению процессы будут удалять систему от равновесия и без внешнего воздействия не могут пойти. Процессы, протекающие сами собой и приближающие систему к равновесию, являются самопроизвольными (положительными). Процессы, не могущие протекать сами собой, без воздействия извне, удаляющие систему от равновесия несамопроизвольные (отрицательные).
В изолированной системе, где исключены внешние воздействия, могут протекать только самопроизвольные процессы.
Т.о., по эмпирическому признаку возможности протекания процесса без сопровождения каким-либо другим процессом все реальные процессы делятся на два типа : положительные и отрицательные. Равновесные процессы лежат на границе между этими двумя классами процессов, не относясь к какому-либо из них.
