
- •«Физическая химия»
- •Энтальпия (Теплосодержание).
- •Стандартные теплоты образования и сгорания.
- •Зависимость теплоты процесса от температуры. (Уравнения Кирхгоффа)
- •Цикл карно.
- •II закон термодинамики.
- •Энтропия в случае неравновесных процессов.
- •Вычисление энтропии. Постулат планка.
- •Энтропия идеального твердого тела
- •Энтропия жидкого вещества
- •Энтропия газа при некоторой т
- •Изохорно-изотермический потенциал (Изохорный потенциал, свободная энергия, энергия Гельмгольца)
- •Изобарно – изотермический потенциал (Изобарный потенциал, энергия Гиббса, свободная энергия при постоянном давлении)
- •Термодинамические потенциалы.
- •Уравнения максимальной работы (уравнения Гиббса-Гельмгольца).
- •Статистический характер II закона термодинамики.
- •При малых и р функция может быть разложена в ряд Маклорена; ограничимся двумя членами ряда:
- •Фазовые переходы первого рода.
- •Если насыщенный пар можно считать идеальным газом, тогда
- •Фазовые переходы второго рода.
- •Зависимость давления насыщенного пара от температуры.
- •Закон смещения равновесия (правило подвижного равновесия)
«Физическая химия»
Курс лекций для студентов III курса химического
факультета
ОСНОВЫ ТЕРМОДИНАМИКИ
(18 час. лекций и 16 час. решения задач)
Лекция 1
Введение : предмет физической химии, история развития, разделы и методы исследования.
Предмет и метод термодинамики, основные понятия. Энергия, теплота, работа. I закон термодинамики. Внутренняя энергия.
Физическая химия (ФХ) изучает взаимосвязь физических и химических явлений, это пограничная отрасль между химией и физикой. Она пользуется теоретическими и экспериментальными методами обеих наук, а также своими собственными методами. ФХ занимается многосторонним исследованием химических реакций и сопутствующих им физических процессов. ФХ уделяет главное внимание исследованию законов протекания химических процессов во времени и законов химического равновесия. Основная общая задача ФХ предсказание временного хода химического процесса и конечного результата в различных условиях на основании данных о строении и свойствах молекул веществ. Знание условий протекания химической реакции приводит к возможности управлять химическим процессом (примеры : синтез NH3, H2SO4 ...).
Термин «ФХ» и определение этой науки впервые были даны М.В.Ломоносовым. Он дал следующее определение физической химии : «Физическая химия есть наука, объясняющая на основании положений и опытов физики то, что происходит в смешанных телах при химических операциях». Это определение близко к современному.
Ломоносов открыл закон постоянства веса при химических реакциях, сформулировал закон сохранения движения, создал стройную качественную кинетическую теорию материи и объяснил теплоту как проявление движения молекул.
Хотя в течение XVIII XIX вв. ФХ не обособилась в отдельную науку и сам термин «ФХ» не использовался, многие крупные физики и химики вели исследования, которые следует отнести к ФХ. Было сделано много важных открытий :
открытие адсорбции газов (Шееле, Швеция, 1773; Фонтана, Франция,
1777);
адсорбции из растворов (Ловиц, Россия, 1875);
каталитических реакций (Деви и Тенар, начало XIX в).
Вольта, Петров, Деви, Гротгус, Фарадей заложили основы электрохимии исследованиями по гальваническим элементам, электролизу и переносу тока в электролитах.
Лавуазье и Лаплас (1779 - 1784) начали изучение теплот химических реакций, что привело к установлению основного закона термохимии закона постоянства сумм теплот (Гесс, 1840).
Огромное значение имело открытие двух законов термодинамики в середине XIX века (Карно, Майер, Гельмгольц, Джоуль, Клаузиус, Томсон).
Количество и разнообразие исследований постоянно возрастало в середине конце XIX века :
развито термодинамическое учение о химическом равновесии (Гульдберг и Вааге, Гиббс);
исследования Вильгельми положили начало изучению скоростей химических реакций (химическая кинетика);
исследовались перенос электричества в растворах (Гиттороф, Кольрауш), законы равновесия растворов с паром (Коновалов), развивалась теория растворов (Менделеев).
Большое значение для оформления ФХ как самостоятельной науки имела деятельность профессора Харьковского университета Бекетова и В.Оствальда. Бекетов с 1865 г. читал лекции по ФХ и организовал в Харьковском университете физико-химическое отделение. В 1887 г. в Лейпцигском университете учреждена первая кафедра ФХ во главе с Оствальдом и основан первый научный журнал по ФХ. В конце XIX в. Лейпцигский университет был центром развития ФХ, а ведущими физико-химиками являлись Оствальд, Вант-Гофф, Аррениус и Нернст.
Если для XIX в. было характерно изучение свойств веществ без учета структуры и свойств молекул, а также использование термодинамики как основного теоретического метода, то в XX веке на первый план выступили исследования строения молекул и кристаллов и применение новых теоретических методов.
Основываясь на успехах физики в области строения атомов и используя теоретические методы квантовой механики и статистической механики, а также новые экспериментальные методы (рентгеновский анализ, спектроскопия, масс-спектрометрия, магнитные методы и др.), физико-химики добились больших успехов в изучении строения молекул и кристаллов и в познании природы химической связи.
Большое развитие получила химическая кинетика, конкретно связываемая со строением молекул и прочностью связей между атомами в молекуле. Возникают и развиваются новые разделы ФХ : магнетохимия, радиационная химия, ФХ полимеров, газовая электрохимия и др.
Разделы ФХ :
Строение вещества (этот раздел можно рассматривать и как часть физики)
Химическая термодинамика
Учение о растворах
Электрохимия :
теория растворов электролитов
учение об ЭДС, гальванические элементы
кинетика электродных процессов
Химическая кинетика и катализ
Фотохимия
Методы физико - химического исследования :
Экспериментальный метод : исследование зависимости свойств веществ от внешних условий, экспериментальное изучение законов протекания химических реакций во времени и законов химического равновесия.
Методы теоретической физики :
квантово - механический метод (лежит в основе учения о строении и свойствах отдельных атомов и молекул и взаимодействии их между собой; факты, относящиеся к свойствам отдельных молекул, получаются, главным образом, с помощью экспериментальных оптических методов)
метод статистической физики (дает возможность рассчитать «макроскопические свойства» на основании сведений о свойствах отдельных молекул)
термодинамический метод (позволяет количественно связывать «макроскопические» свойства вещества и рассчитывать одно из этих свойств на основании опытных величин др. свойств).
Предмет термодинамики изучение законов взаимных превращений различных видов энергии, связанных с переходом энергии между телами в форме теплоты и работы.
Различие между теплотой и работой, принимаемое термодинамикой как исходное положение, имеет смысл только для тел, состоящих из множества молекул. Поэтому термодинамика рассматривает лишь макроскопические системы, не принимая во внимание поведение и свойства отдельных молекул.
Объектом исследования является термодинамическая система (система) тело или группа тел, находящихся во взаимодействии, мысленно обособляемые от окружающих тел.
Система является гомогенной, если каждый параметр ее имеет во всех частях системы одно и то же значение или непрерывно изменяется от точки к точке ; внутри нее нет поверхностей раздела, которые отделяли бы друг от друга части системы, отличающиеся по свойствам. Система является гетерогенной, если она состоит из нескольких макроскопических частей, отделенных одна от другой видимыми поверхностями раздела ; на этих поверхностях некоторые параметры изменяются скачком. Однородная система такая, в которой все участки объема обладают одинаковым составом и свойствами. Неоднородная система может быть и гомогенной, если ее состав и свойства изменяются постепенно, без образования поверхностей раздела.
Фаза совокупность всех гомогенных частей системы, одинаковых по составу, физическим и химическим свойствам и отграниченных друг от друга поверхностью раздела. Гомогенная система представляет собой одну фазу, гетерогенная содержит не менее двух. Фазы, состоящие из химически индивидуальных веществ простые (чистые) ; фазы, состоящие из двух или более веществ смешанные.
Система, которая не может обмениваться с окружающей средой веществом и энергией (в форме теплоты и работы) и имеет постоянный объем изолированная. Закрытая система лишена возможности обмениваться с окружающей средой веществом, но может обмениваться энергией и не сохранять объем.
Совокупность всех физических и химических свойств системы характеризует ее состояние. Изменение каких-либо свойств (даже одного) означает изменение термодинамического состояния системы. Параметр состояния (термодинамический параметр) любая из величин, служащая для характеристики состояния системы (Т, Р, V, внутренняя энергия, концентрация, энтропия, энтальпия, изобарный потенциал ...).
В термодинамике рассматриваются такие состояния системы, при которых ряд ее свойств не изменяется самопроизвольно во времени и имеет одинаковое значение во всех точках объема отдельных фаз ; такие состояния называются равновесными.
Всякое изменение, происходящее в системе, называется термодинамическим процессом. Параметром процесса называется любая из термодинамических величин, которая служит для характеристики процесса : U изменение внутренней энергии, теплота испарения, теплота плавления ... . Конечное изменение параметра : X, б/м изменение : dX, Х.
Если изменение параметра состояния зависит только от начального и конечного состояния системы и не зависит от пути процесса, то такой параметр называется функцией состояния системы. Для нее : Х = Х2 Х1 .
Процесс, при котором термодинамическая система, выйдя из начального состояния и претерпев ряд изменений, возвращается в это же состояние круговой процесс (цикл).
Неотъемлемым свойством (атрибутом) материи является движение ; оно неуничтожимо, как сама материя. Движение материи проявляется в разных формах, которые могут переходить одна в др. Мерой движения материи является энергия.
Закон сохранения и превращения энергии : энергия не создается и не разрушается, она переходит из одного вида в другой в эквивалентных количествах (иначе : нельзя построить вечный двигатель 1-го рода, дающий работу без затраты эквивалентного количества другого вода энергии). Закон сохранения и превращения энергии универсален : он применим и к явлениям, протекающим в сколь угодно больших телах, и к явлениям, происходящим с участием одной или немногих молекул.
Изменения форм движения при переходе его от одного тела к др. и соответствующие превращения энергии весьма разнообразны ; формы же самого перехода движения (энергии) могут быть разбиты на 2 группы :
1. В первую группу входит только одна форма перехода движения путем хаотического столкновения молекул двух соприкасающихся тел, т.е. путем теплопроводности (и одновременно путем излучения). Мерой передаваемого т.о. движения является теплота.
2. Во вторую группу включаются различные формы перехода движения, общей чертой которых является перемещение масс, охватывающих очень большое число молекул (т.е. макроскопических масс), под действием каких-либо сил. Общей мерой передаваемого таким образом движения является работа. Работа может быть качественно своеобразна, но любой вид работы всегда может быть полностью превращен в работу поднятия тяжести и количественно учтен в этой форме.
Т.о., теплота и работа характеризуют качественно и количественно две различные формы передачи движения от одной части материального мира к другой.
I закон термодинамики это закон сохранения энергии в применении к теплоте и работе :
Q = A + U математическое выражение I ЗТ.
Тепло, сообщаемое системе, расходуется на совершение системой работы и приращение внутренней энергии системы.
Для б/м превращений :
Q = A + dU
- б/м величины А и Q (элементарная А и элементарная Q)
d - полный дифференциал
Q = A + U2 U1
U2 в конечном состоянии, U1 в начальном состоянии
«U» представляет собой совокупность кинетической и потенциальной энергии молекул, атомов, составных частей атомов и лучистой энергии. «U» является однозначной, непрерывной и конечной функцией состояния системы; «U» системы, находящейся в данном состоянии, имеет одно определенное значение и не зависит от того, каким изменениям система подвергалась перед этим; разность «U» системы в двух ее состояниях не зависит от пути перехода системы из исходного состояния в конечное, а только от исходного и конечного состояний.
Если процесс круговой, то U2 = U1 и Q = A.
В изолированной системе : Q = 0 и А = 0 , т.е. при любых процессах, протекающих в изолированной системе, U = 0, U = const : внутренняя энергия изолированной системы постоянна.
Работа, совершаемая системой при переходе из одного состояния в другое, зависит от пути процесса, т.е. от величины и характера изменений внешних параметров системы в ходе процесса ; покажем это.
dh S S P, V
|
Пусть в сосуде с поршнем находится идеальный газ под давлением Р. Если внешнее давление меньше внутреннего на бесконечно малую величину, то идет процесс расширения : поршень сместится вверх на величину dh . А
= PS
dh = PdV ; A =
|
В координатах P, V работа А равна площади криволинейной трапеции.
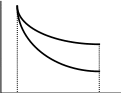
Пусть внешнее давление меняется неоднократно и скачкообразно (например, путем поднятия гирек, стоящих на поршне). Рассмотрим график расширения (и обратного сжатия) в координатах P, V (рис. (а), (б)). Расширение нижняя ломаная кривая : за скачкообразным уменьшением внешнего давления следует увеличение объема, продолжающееся до тех пор, пока система не придет в состояние равновесия. В этом состоянии система будет оставаться до нового скачкообразного уменьшения давления извне и т.д. Обратный процесс сжатие отображается верхней ломаной кривой. Система возвращается в исходное состояние. Видно (сравнением площадей под ломаными кривыми), что работа, совершенная над системой при сжатии, больше, чем работа расширения.
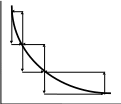
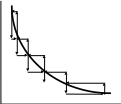 P
1
P
1
P
1
P
1

2 2
V V
(а) (б)
На рис. (б) изображен процесс, протекающий между теми же исходным и конечным состояниями, но скачки Р и V здесь меньше, чем на рис. (а). Кривые прямого и обратного процесса сблизились. Работа расширения, совершенная системой в процессе (б), больше, чем работа расширения в процессе (а) (для работы сжатия все обстоит наоборот).
Поскольку Q = A + U , то в общем случае теплота также зависит от пути процесса.
В термодинамике положительной считается теплота, полученная системой от окружающей среды, и работа, произведенная системой.
I ЗТ не дает возможности найти полное значение внутренней энергии системы в каком-либо состоянии, т.к. уравнения, выражающие I ЗТ, приводят только к вычислению изменения «U» в различных процессах. Точно так же нельзя непосредственно измерить изменения «U» в макроскопических процессах; можно лишь вычислить эти изменения, учитывая измеримые величины Q и А данного процесса.
Можно измерить полный запас энергии некоторых элементарных частиц, т.к. при их превращениях в излучение вся энергия частиц переходит в энергию фотонов, которая известна.
Лекция 2
Приложение I закона термодинамики к некоторым частным процессам. Энтальпия.
ИЗОХОРНЫЙ ПРОЦЕСС ( V = const )
Q = A + dU
A = PdV = 0 (т.к. dV = 0 ) ; QV = dU ; QV = U
Изменение U в изохорном процессе равно количеству выделяемой или поглощаемой теплоты : все тепло, подводимое к системе, идет на увеличение ее внутренней энергии, и наоборот, если тепло выделяется, то это происходит за счет уменьшения «U».
Введем понятие теплоемкости : это теплота, поглощаемая при нагревании 1 г или 1 моля вещества (т.е. удельная с или мольная С теплоемкость) на Т градусов в тех или иных условиях (V = const, P = const или др. условия).
Средние
теплоемкости :
![]() ,
,
![]()
Истинные
теплоемкости : СV
=
![]() , CP
=
, CP
=
![]()
Для изохорного процесса :
СV
=
=
![]() ; dU
= CV
dT
; U
= CV
T
; dU
= CV
dT
; U
= CV
T
Изменение внутренней энергии идеального газа пропорционально изменению температуры.
ИЗОБАРНЫЙ ПРОЦЕСС ( P = const )
QP = A + dU = PdV + dU
A = P (V2 V1) = P V
P
1 2
V1 V2 V |
На рис. приведен график изобарного расширения или сжатия. Работа равна площади прямоугольника. QP = U + P V Qp = QV + P V Qp QV = P V Разность теплот изобарного и изохорного процесов равна работе изобарного расширения или сжатия.
|
Qp = QV + PdV
Продифференцируем это выражение по Т :
=
+
![]() =
+
=
+
![]()
(т.к. PV = RT для 1 моля идеального газа уравнение Менделеева-Клапейрона).
СР = СV + R
CP CV = R уравнение Майера
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС ( T = const)
dU = CV dT = 0
Внутренняя энергия идеального газа в изотермическом процессе остается без изменения.
P 1
2
V1 V2 V |
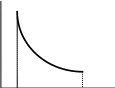
PV = RT = const для изотермы A = PdV A
=
=
RT ln
Для n молей A = nRT ln |
dU = 0 , U = 0 , Q = A
Теплота изотермического процесса равна работе процесса.
Закон Гей-Люссака–Джоуля : Внутренняя энергия идеального газа не зависит от давления и объема, а зависит только от температуры.
АДИАБАТИЧЕСКИЙ ПРОЦЕСС ( Q = 0 , Q = 0 )
Это процесс, протекающий без теплообмена между системой и окружающей средой.
PdV + CV dT = 0
![]() dV
+ CV
dT
= 0 /
:
T
dV
+ CV
dT
= 0 /
:
T
R![]() + CV
+ CV
![]() = 0
= 0
R = CP CV (CP CV) + CV = 0 / : CV
(![]()
1)
+
= 0 ,
=
1)
+
= 0 ,
=
После интегрирования : ln V-1 + ln T = const
ln TV-1 = const
TV-1 = const (1)
T
=
![]() ,
V-1
= const
,
V-1
= const
PV = const (2)
Уравнения (1) и (2) уравнения адиабаты (уравнения Пуассона).
Работа при адиабатическом процессе :
A
+ CV
dT
= 0 , A
=
CV
dT
, A =
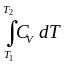 = CV
(T1
T2)
= CV
(T1
T2)
A 0 при расширении Т падает при адиабатическом расширении, т.е. работа адиабатического расширения совершается за счет уменьшения внутренней энергии. При адиабатическом сжатии U увеличивается, Т растет.
A
= CV
(T1
T2)
= CV
(![]()
![]() )
=
)
=
![]() (P1V1
P2V2)
(P1V1
P2V2)
A
=
![]() (P1V1
P2V2)
=
(P1V1
P2V2)
=
![]() (P1V1
P2V2)
=
(P1V1
P2V2)
=
![]() (P1V1
P2V2)
(P1V1
P2V2)
изотерма
адиабата
V1 V2 V |
Сравним : PV = const (адиабата) и PV = const (изотерма) : P
=
Адиабата идет круче, чем изотерма.
|


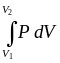

 =
=
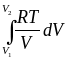 = RT ln
= RT ln
 P
P