
- •«Физическая химия»
- •Энтальпия (Теплосодержание).
- •Стандартные теплоты образования и сгорания.
- •Зависимость теплоты процесса от температуры. (Уравнения Кирхгоффа)
- •Цикл карно.
- •II закон термодинамики.
- •Энтропия в случае неравновесных процессов.
- •Вычисление энтропии. Постулат планка.
- •Энтропия идеального твердого тела
- •Энтропия жидкого вещества
- •Энтропия газа при некоторой т
- •Изохорно-изотермический потенциал (Изохорный потенциал, свободная энергия, энергия Гельмгольца)
- •Изобарно – изотермический потенциал (Изобарный потенциал, энергия Гиббса, свободная энергия при постоянном давлении)
- •Термодинамические потенциалы.
- •Уравнения максимальной работы (уравнения Гиббса-Гельмгольца).
- •Статистический характер II закона термодинамики.
- •При малых и р функция может быть разложена в ряд Маклорена; ограничимся двумя членами ряда:
- •Фазовые переходы первого рода.
- •Если насыщенный пар можно считать идеальным газом, тогда
- •Фазовые переходы второго рода.
- •Зависимость давления насыщенного пара от температуры.
- •Закон смещения равновесия (правило подвижного равновесия)
Энтропия в случае неравновесных процессов.
Q1 Q2 = A ; А в необратимом цикле меньше, чем в обратимом
1 1 ; ; 0
Для б/м цикла Карно 1-го вида :
0 ; 0 неравенство Клаузиуса
Пусть в цикле переход (а) (1 2) равновесен, переход (b) (2 1) неравновесен (круговой процесс в целом неравновесен) :
=
+
![]()
0
0
;
![]()
(поскольку переход (а) равновесен, пределы интегрирования можно поменять местами)
;
dS
![]()
В
общем случае : dS
![]()
TdS dU + A dU TdS A A TdS dU |
Эти равенства охватывают уравнения I и II ЗТ ; они справедливы и для равновесных, и для неравновесных процессов. |
Если система изолированная (Q = 0), то dS 0 :
Равновесные процессы : dS = 0, S = const энтропия изолированной системы постоянна, если в ней протекают равновесные процессы.
Неравновесные процессы : dS 0 , S2 S1 , S растет.
Исследуя энтропию, можно предсказать направление процесса. Если в изолированной системе для какого-либо процесса энтропия возрастает, то процесс возможен (может протекать самопроизвольно); если энтропия изолированной системы согласно расчету должна убывать, то процесс невозможен (отрицателен). При постоянстве энтропии процесс равновесен, система бесконечно близка к равновесию.
самопро- несамопро- извольн. извольн.
равн |
В изолированной системе процессы прекратятся тогда, когда S достигнет максимального значения, возможного для данной системы при постоянстве некоторых ее параметров, а именно при постоянстве U и V (условия изолированной системы). Дальнейшее изменение состояния системы должно было бы вызвать уменьшение S, что в изолированной системе невозможно. Т.о., признаком равновесия изолированной системы является максимальное значение S при U, V = const . |
(S)U,V = 0, ( 2S)U,V 0 условие равновесия в изолированной системе
(S)U,V 0 условие самопроизвольного протекания процесса в изолированной системе
В системе, обменивающейся теплотой и работой с окружающей средой, возможны процессы, сопровождающиеся как возрастанием, так и убыванием S. Поэтому для решения вопроса о направлении процесса следует включить в систему все тела, участвующие в процессе, и т.о. сделать систему изолированной.
Вычисление энтропии. Постулат планка.
Уравнения, определяющие энтропию, являются единственными исходными уравнениями для термодинамического расчета изменений системы :
dS
=
; S
= S2
S1
=
![]()
Фазовые превращения (изотермический процесс)
![]() =
=
![]() ; S
= S2
S1
=
; S
= S2
S1
=
![]() =
=
![]()
(здесь Q теплота плавления, испарения ... теплота фазового перехода)
Изотермическое расширение идеального газа
S
=
=
![]() = R ln
= R ln
= R ln
= R ln
Для n молей : S = nR ln = nR ln
Нагревание при постоянном Р (изобарный процесс)
S
=
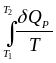 =
=
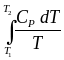
Надо знать зависимость СР от Т. Допустим, СР = a + bT :
S
=
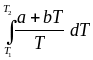 =
=
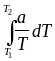 +
+
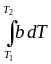 = a
ln
+ b
(T2
T1)
= a
ln
+ b
(T2
T1)
Процесс связан с изменением T, V, P (общий случай)
Процесс связан с изменением T и V :
dS
=
=
![]() =
=
![]()
S
=
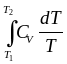 +
+
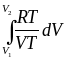 = CV
ln
+ R ln
= CV
ln
+ R ln
Процесс связан с изменением Т и Р :
S = (CP R) ln + R ln = CP ln R (ln ln ) =
=
CP
ln
R ln
![]() = CP
ln
R ln
= CP
ln
R ln
![]()
(полагаем СV и СР независимыми от Т, что справедливо лишь для узких интервалов Т)
По вышеприведенным уравнениям невозможно вычислить абсолютное значение энтропии. Такую возможность дает недоказуемое положение, не вытекающее из двух законов термодинамики, сформулированное Планком (1912). Постулат Планка : энтропия индивидуального кристаллического вещества при абсолютном нуле равна нулю : So = 0.
dS = CV + R ; S = CV ln T + R ln V + So
dS
= CP
R
![]() ; S = CP
ln
T
R ln
P + So
; S = CP
ln
T
R ln
P + So
Постулат Планка используется для вычисления абсолютных значений энтропий химических соединений величин, которые имеют большое значение при расчете химических равновесий.
Строго говоря, постулат справедлив только для индивидуальных веществ, кристаллы которых идеально построены : в кристаллической решетке все узлы заняты атомами или молекулами, правильно чередующимися и закономерно ориентированными. Такие кристаллы называют идеальными твердыми телами. Реальные кристаллы не являются таковыми; идеальное твердое тело абстракция. Энтропия кристаллической решетки, построенной беспорядочно, больше нуля при Т = 0. Однако для хорошо образованных кристаллов индивидуальных веществ она невелика.

 S
S