
- •Понятие химическое вещество и химическая реакция. Основные типы химических реакций.
- •Классификация химических реакций.
- •Понятие химическое в-во и хим. Реакция.
- •Классификация химических реакций.
- •I. В зависимости от механизма реакции могут быть отнесены к простым и сложным.
- •2) Последовательными реакциями называются реакции, при которых продукт начальной реакции является исходным веществом для следующей реакции.
- •II. По признаку изменения числа исходных и конечных веществ реакции можно выделить такие типы:
- •1. Реакции, идущие без изменения степеней окисления элементов:
- •2. Окислительно-восстановительные реакции:
- •IV. По признаку выделения или поглощения энергии реакции делят на экзотермические и эндотермические.
- •V. По признаку обратимости реакции подразделяются на две группы: необратимые и обратимые.
- •1) Необратимые реакции могут идти только в одном направлении и протекают до полного завершения.
- •2) Обратимыми называются реакции, протекающие в двух противоположных направлениях: прямом и обратном.
1. Реакции, идущие без изменения степеней окисления элементов:
SO2 + Н2O = H2SO3
СаСО3 = СаО+СО2
A1(ОН)3 + 3HС1 = AlCl3 + 3H2O
2. Окислительно-восстановительные реакции:
Реакции, при которых изменяются степени окисления элементов, входящих в состав реагирующих веществу, называются окислительно-восстановительными.
Например, в реакции:
![]()
медь н железо изменяют свои степени окислении: степень окисления меди понижается от + 2 до 0, степень окисления железа повышается от 0 до + 2. Ион меди (II) присоединяет два электрона – восстанавливается:
![]() –
процесс восстановления
–
процесс восстановления
Атом железа отдает два электрона – окисляется:
![]() –
процесс окисления
–
процесс окисления
IV. По признаку выделения или поглощения энергии реакции делят на экзотермические и эндотермические.
В ходе всех химических реакций происходит выделение или поглощение энергии, т. е. имеет место обмен энергией между системой и внешней средой. Обмен энергией может происходить в разных формах: чаще всего в виде теплоты, а также в виде светового излучения, акустических волн и т. д. Так как существует эквивалентность между разными видами энергии, то количество энергии, которой химическая система обменивается с внешней средой, можно свести к количеству теплоты.
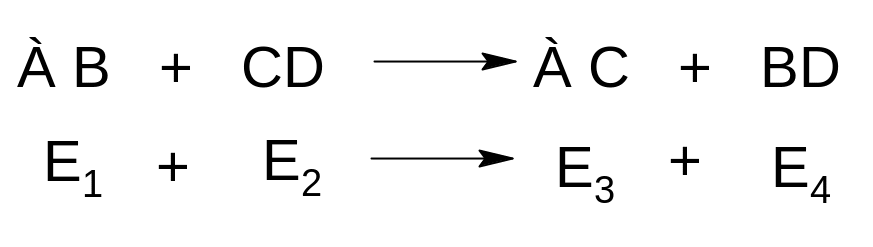
Если Е1 + Е2 > Е3 + Е4 , тот энергия выделяется и эта реакция экзотермическая.
Если Е1 + Е2 < Е3 + Е4 , тот энергия поглощаетсяется и эта реакция эндотермическая.
Реакции, протекающие с выделением теплоты, называют экзотермическими, с поглощением теплоты – эндотермическими.
Количество выделенной или поглощенной теплоты при данных количествах реагирующих веществ называют тепловым эффектом реакции. Тепловой эффект реакций определяется разностью энергий связи, которые образуются и разрываются.
В термохимических уравнениях химических реакций тепловой эффект указывают при помощи величины H, которая называется изменением энтальпии (теплосодержания) реакции.
(Е3 + Е4) – (Е1 + Е2) = H
Химические уравнения, в которых указан тепловой эффект реакций называются термохимическими уравнениями. Если реакция протекает при стандартных условиях (температуре 289,15 К или 25 0С, давлении 101 325 Па, концентрации всех веществ в растворе или в газе 1 моль в литре), то изменение энтальпии обозначают символом H0.
Если H<0, то теплота выделяется, т.е. реакция – экзотермическая. Для эндотермических реакций H>0.
Существуют две формы записи термохимических уравнений. В одном случае (термохимическая форма) тепловой эффект записывается в самом уравнении, обычно в его правой части; при этом тепловой эффект экзотермической реакции входит в уравнение со знаком "+", а эндотермической — со знаком "–", т. е. знак соответствует величине (,). Например:
H2 + Cl2 = 2 HCl + 185 кДж – экзотермическая реакция
N2 + O2 = 2 NO – 181 кДж – эндотермическая реакция
В других случаях после записи уравнения реакции отдельно записывают Н реакции, знак которой противоположен знаку <2 • Например:
H2 + Cl2 → 2 HCl, H0 = –185 кДж
N2 + O2 → 2 NO, H0 = + 181 кДж
Эта система записи принята в химической термодинамике (термодинамическая форма записи).
Тепловой эффект реакции образования какого-либо соединения — это не только важная характеристика данного соединения, но и величина, позволяющая оценить его устойчивость. Последующее развитие химии в основном подтвердило правильность этого положения.
Вещества, образующиеся из простых веществ (хотя бы теоретически) в результате экзотермической реакции, называются экзотермичными; процесс их разложения на простые вещества, наоборот, эндотермический. Так, экзотермичным веществом является вода. Вещества, образующиеся из простых веществ (хотя бы теоретически) в результате эндотермических процессов, называются эндотермичными; процесс их разложения на простые вещества - экзотермический.
Все эндотермичные соединения неустойчивы (поскольку эта неустойчивость определяется законами термодинамики, правильнее сказать термодинамически неустойчивы), причем, чем более эндотермичным является соединение, тем более оно неустойчиво, т. е. тем легче оно разлагается. И наоборот, чем более экзотермичным является соединение, тем труднее его разложить (например, путем термического разложения).
Так, ацетилен С2Н2, являясь эндотермичным соединением, при определенных условиях может разлагаться со взрывом, поэтому его хранят и транспортируют в газовых баллонах не в чистом виде, а растворенным в ацетоне, так как разбавление легко взрывающегося вещества другим, инертным по отношению к нему веществом, предотвращает возможность взрыва.
Термодинамически неустойчивы все вещества или смеси веществ, которые используются в качестве взрывчатых веществ. В этом случае экзотермической может быть реакция их распада как до более простых соединений, так и до простых веществ. Смесь веществ может быть термодинамически неустойчивой, т. е. взрывчатой, из-за возможности экзотермической реакции между ее компонентами, поэтому могут взрываться гремучий газ и смесь древесных опилок с жидким кислородом. Белый фосфор эндотермичен по отношению к красному, поэтому при хранении он постепенно превращается в красный. Таких примеров можно привести много. Напротив, такие соединения, как вода или оксид титана, весьма экзотермичны (соответственно -286 и -912 кДж/моль), а потому - весьма устойчивы.
Устойчивость экзотермичных соединений и неустойчивость эндотермичных - это проявление общей закономерности, которая получила название принципа Бертло — Томсена, согласю которому химические процессы идут преимущественно в экзотермическом направлении.
