- •1 Общая характеристика: – классификация, номенклатура, изомерия.
- •2. Физические свойства карбоновых кислот
- •3. Способы получения
- •4. Химические свойства
- •5 Отдельные представители. Методы идентификации.
- •Карбоновые кислоты
- •Одноосновные карбоновые кислоты
- •1.1 Гомологический ряд и номенклатура
- •1.2 Физические свойства карбоновых кислот
- •Химические свойства
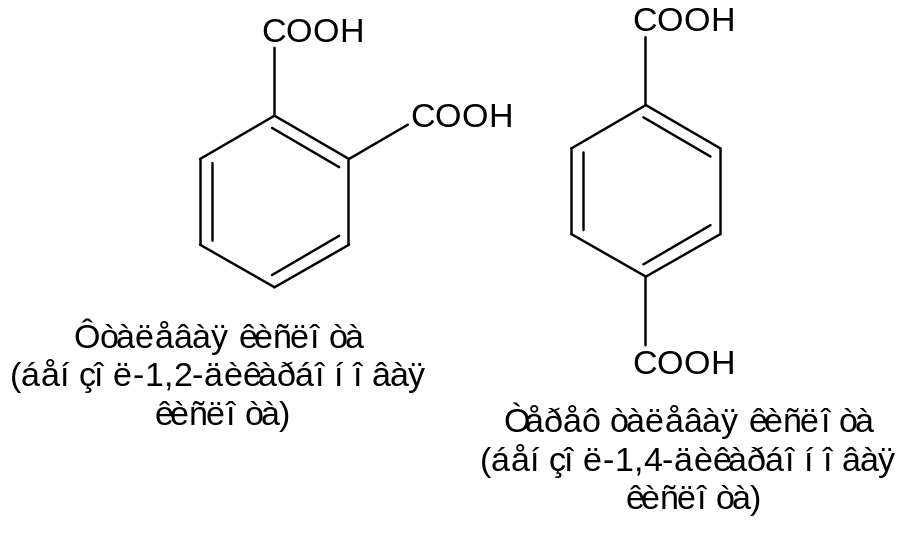
- •2. Двухосновные карбоновые кислоты
- •3. Непредельные карбоновые кислоты
ТЕМА ЛЕКЦИИ № 18 КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРИОЗВОДНЫЕ
ВОПРОСЫ:
1. Общая характеристика: – классификация, номенклатура, изомерия.
2. Физические свойства карбоновых кислот
3. Методы получения.
4. Химические свойства.
5. Производные карбоновых кислот
5. Отдельные представители. Методы идентификации.
1 Общая характеристика: – классификация, номенклатура, изомерия.
Карбоновыми
кислотами называются соединения, в
которых функциональной группой является
карбоксильная группа
![]() .
Название группы «карбоксильная»
происходит от названия составляющих
ее групп – карбонильной
.
Название группы «карбоксильная»
происходит от названия составляющих
ее групп – карбонильной
![]() и гидроксильной –ОН.
и гидроксильной –ОН.
Общая формула карбоновых кислот для:
одноосновных
|
ароматических
|
Классификация
По числу карбоксильных групп различают:
1– Одноосновные (монокарбоновые)
Н–СООН – муравьиная кислота (метановая);
СН3–СООН – уксусная кислота (этановая);
С6Н5–СООН – бензойная кислота
2 – Двухосновные (дикарбоновые)
НООС–СООН – щавелевая кислота (этандиовая);
НООС–СН2–СООН – малоновая кислота (пропандиовая).
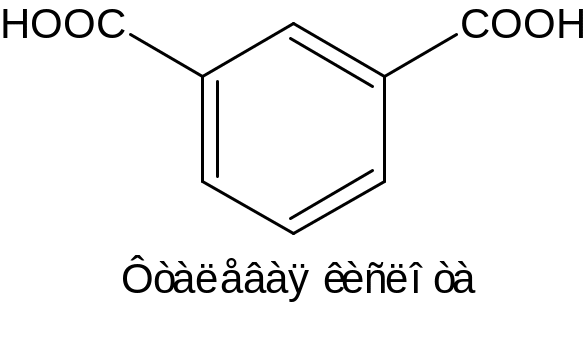
НООС–С6Н4–СООН – фталевая кислота.
3 – Трикарбоновые и т.д.

В зависимости от строения углеводородного радикала, связанного с карбоксильной группой, различают:
1 Предельные карбоновые кислоты, СnH2nO2 или
Сn-1H2n-1 –COOH
СН3–СООН – уксусная кислота (этановая);
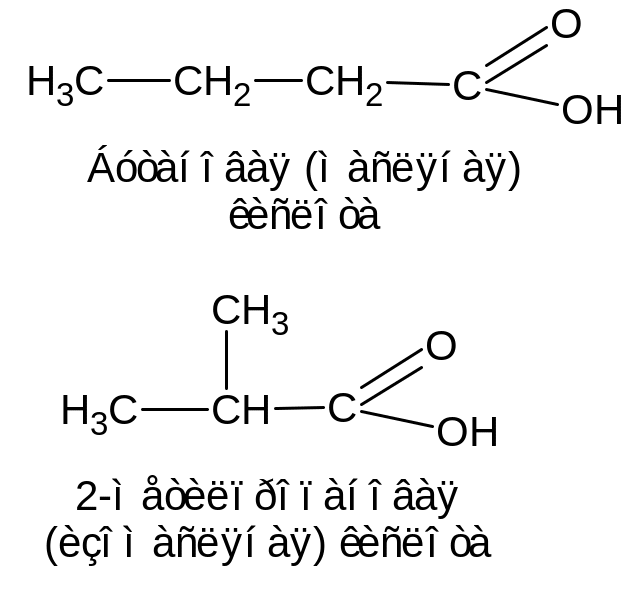
СН3–СН2–СН2–СООН – пропановая (пропионовая) кислота;
СН3–(СН2)14 СООН – пальмитиновая кислота;
СН3–(СН2)16 СООН – стеариновая кислота;
2 Непредельные
– (с одной двойной связью)
СН2=СН–СООН пропеновая (акриловая)
СН3–(СН2)4 –СН=СН–(СН2)7–СООН – олеиновая кислота
– (с двумя двойными связями)
СН3–(СН2)4 –СН=СН–СН2–СН=СН–(СН2)7–СООН – линолевая кислота.
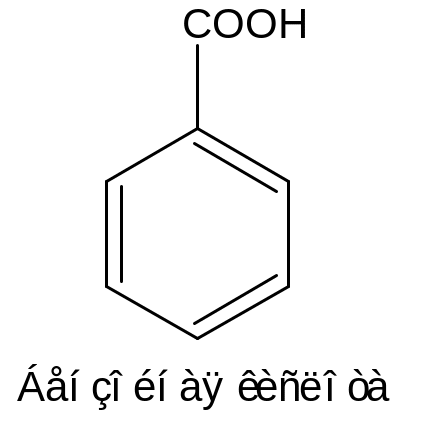
3 – Ароматические
|
|
4 – Гетероциклические и т.д.
Номенклатура.
Для наименования карбоновых кислот широко применяются тривиальные названия, которые часто связаны с первыми источниками их получения: муравьиная, уксусная, стеариновая. По номенклатуре ИЮПАК в основе наименования кислот положено название углеводорода с тем же числом атомов углерода, к которому прибавляется суффикс с окончанием «овая», нумерация начинается с атома углерода карбоксильной группы:
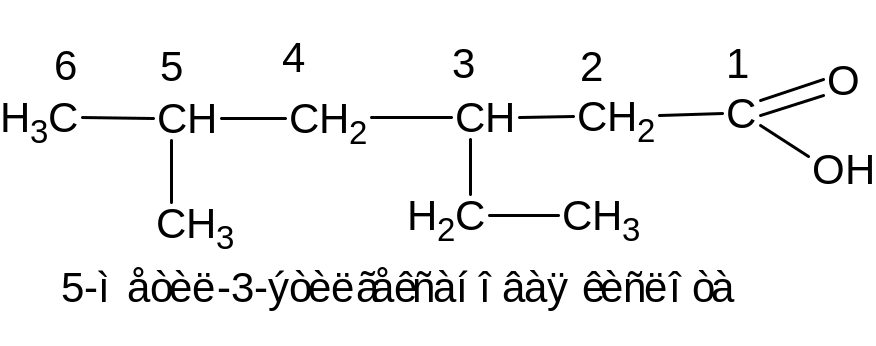
Изомерия.
Изомерия определяется строением углеводородного радикала. Для ароматических кислот строением радикала и положением карбоксильной группы.
|
|
2. Физические свойства карбоновых кислот
Первые три кислоты (метановая (муравьиная), этановая (уксусная) и пропановая (пропионовая) – подвижные жидкости с резким запахом. Начиная с С4 (бутановая (масляная)) – маслянистые жидкости с крайне неприятным запахом (запах прогорклого сливочного масла). С С10 и выше карбоновые кислоты являются твердыми веществами, без цвета и запаха. Низкомолекулярные карбоновые кислоты хорошо растворимы в воде, с увеличением молекулярной массы растворимость их падает.
3. Способы получения
Карбоновые кислоты широко распространены в природе, как в свободном состоянии, так и в виде структурных компонентов ряда природных органических веществ (жиров).
4. Химические свойства
Химическое поведение карбоновых кислот, в первую очередь, связано с наличием в их молекуле карбоксильной группы, а также со строением углеводородного радикала.
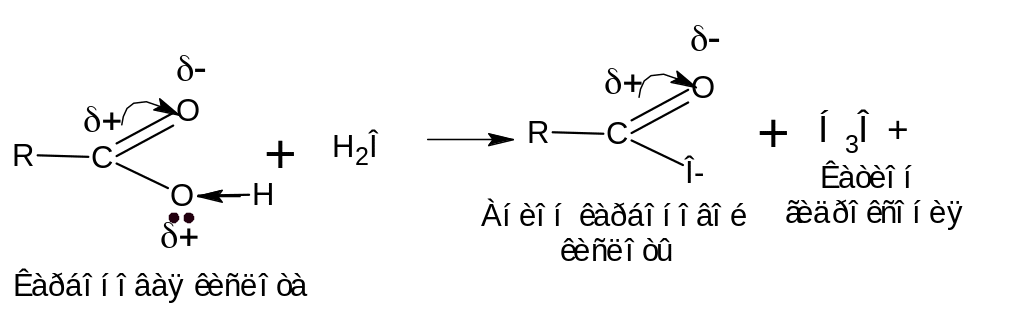
Рассмотрим распределение электронной плотности в карбоксильной группе недиссоциированной карбоновой кислоты. Электронная плотность -
связи в группе смещена в сторону атома кислорода. Вследствии этого у атома углерода создается недостаток электронной плотности, и он притягивает к себе неподеленные электронные пары от кислорода гидроксильной группы. В результате электронная плотность О–Н-связи смещается в сторону атома кислорода, водород становиться подвижным и приобретает способность отщепляться в виде протона:
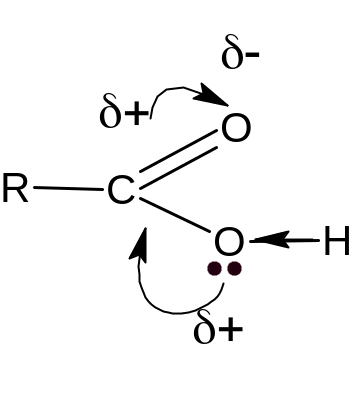
В водном растворе карбоновая кислота диссоциирует с образованием аниона карбоксильной кислоты и катиона гидроксония (протона).