
- •1 Основные положения теории электролитической диссоциации
- •Истинные и потенциальные электролиты
- •2) Гидратация этих ионов.
- •3 Степень диссоциации
- •4 Константа диссоциации
- •5 Ионные реакции
- •6 Ионное произведение воды. Водородный показатель
- •7 Буферные растворы
- •9 Гидролиз. Степень гидролиза. Константа гидролиза
- •Гидролиз солей, соответствующих сильному основанию и слабой кислоте
- •2. Гидролиз солей, соответствующих слабому основанию и сильной кислоте
ЛЕКЦИЯ №7 : ИОННО-МОЛЕКУЛЯРНЫЕ РЕАКЦИИ
ВОПРОСЫ:
Основные положения теории электролитической диссоциации
Истинные и потенциальные электролиты
Степень диссоциации
Константа диссоциации
Ионные реакции
Ионное произведение воды. Водородный показатель
Буферные растворы
Гидролиз. Степень гидролиза. Константа гидролиза
1 Основные положения теории электролитической диссоциации
Теория электролитической диссоциации была разработана в 1887 году шведским учёным С. Аррениусом.
Согласно этой теории, существуют вещества, способные в растворах и расплавах распадаться (диссоциировать) на ионы, вследствие чего растворы и расплавы этих веществ, проводят электрический ток. Эти вещества были названы электролитами.
Электролитами в водных растворах являются кислоты, основания и соли. При растворении электролиты диссоциируют на положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Катионы под действием электрического поля движутся к катоду, а анионы под действием электрического поля движутся к аноду.
Недостатки теории Аррениуса:
Теория Аррениуса не учитывала, что ионы являются свободными и независимыми частицами от молекул растворителя.
При растворении электролитов в воде одновременно с процессом их диссоциации на ионы, происходит процесс гидратации ионов.
В процессе электролитической диссоциации водные растворы электролитов:
– во-первых, проводят электрический ток, так как в них присутствуют носители электрического заряда — ионы.
– во-вторых, в результате электролитической диссоциации увеличивается число частиц растворенного вещества, а, следовательно, их концентрация, поэтому возрастают и отклонения свойств раствора от свойств чистого растворителя.
Например, при полной диссоциации 1 моль NаС1 в растворе окажется 1 моль ионов Nа+ и 1 моль ионов Сl, т. е. общее количество частиц составит 2 моль.
Истинные и потенциальные электролиты
Каковы же причины диссоциации электролитов в водных растворах?
Электролиты можно разделить на две группы: истинные и потенциальные.
Истинные электролиты - это вещества, имеющие ионную кристаллическую решетку. К истинным электролитам относятся соли, а также гидроксиды щелочных металлов.
Рассмотрим растворение истинного электролита, рис. 1:
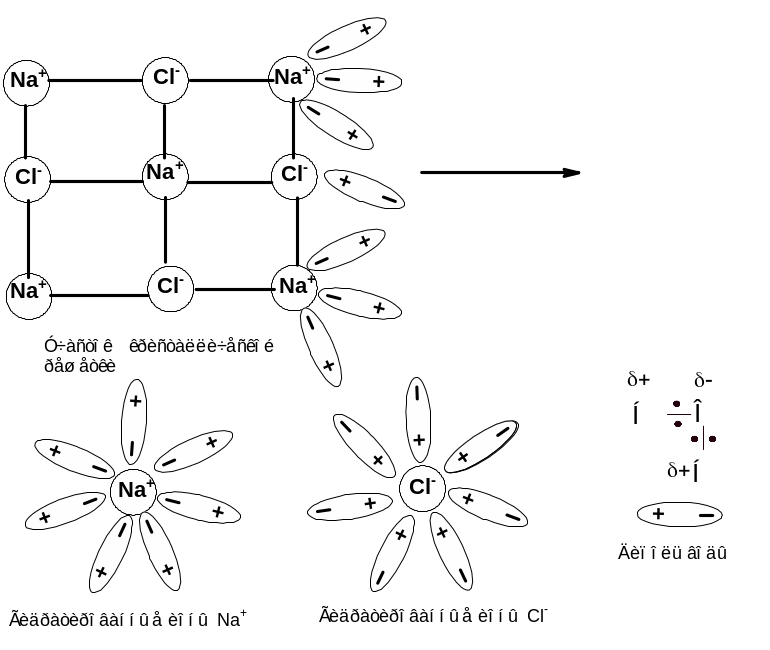
Рисунок 1 – Растворение истинного электролита
Роль воды при растворении истинного электролита, например, хлорида натрия, заключается в следующем:
– Поскольку в кристаллической решетке этого вещества уже имеются заряженные частицы, то на поверхности кристалла будет иметь место взаимодействие между этими заряженными частицами и полярными молекулами воды (рис 1 ).
– Это взаимодействие ослабит связь между ионами в решетке, и тем самым будет способствовать их переходу в раствор в виде гидратированных ионов.
– При растворении хлорида калия в раствор будут переходить катионы Na+ и анионы Сl–, причем молекулы воды будут притягиваться к ионам Na+ отрицательными концами, а к ионам Сl– - положительными.
Таким образом, вокруг каждого из ионов возникает гидратная оболочка из молекул воды, ориентированных определенным образом.
С энергетической точки зрения процесс растворения кристалла хлорида натрия с образованием гидратированных ионов Na+ и Сl– можно представить состоящим из двух процессов:
1) превращение кристалла в свободные ионы Na+ и Сl–;
