
- •2. Квантово-механическая теория химической связи
- •Типы химических связей и их свойства.
- •3.1 Ковалентная связь
- •1) Обменному, когда каждый из соединяющихся атомов имеет на валентном уровне неспаренный электрон, который он предоставляет для образования общей электронной пары;
- •2) Донорно-акцепторному, когда один из соединяющихся атомов предоставляет электронную пару, а другой — вакантную орбиталь, на которой она может разместиться.
- •Параметры химической связи
ЛЕКЦИЯ 3
ТЕМА: ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
ВОПРОСЫ:
1 Общие представления о химической связи. Теории химической связи.
2 Квантово-механическая теория химической связи.
3 Основные типы химической связи:
3.1 Ковалентная
3.2 Ионная
3.3 Металлическая
3.4 Водородная
Параметры химической связи
1 Общие представления о химической связи.
Теории химической связи
Химическая связь – это совокупность взаимодействий между атомами приводящие к образованию устойчивых структур (молекул, ионов, кристаллов, комплексов и др.)
Первая теория химической связи возникла в начале 19 века. Берман и Бертолли выдвинули гравитационную теорию химической связи, согласно которой взаимодействие между атомами связывали с гравитационными взаимодействиями, т.е. силами притяжения. Но это условие не выполнялось.
Вторая теория. Берцелиус выдвинул электронно-химическую теорию химической связи, согласно которой атомы состоят их 2-х полюсов (+ и –), причем преобладает какой-нибудь один из полюсов. Разнозаряженные атомы притягиваются друг к другу и образуют химическую связь. В этой теории также были недостатки.
Третья теория. Теория строения атома явилась предпосылкой для создания теории химической связи. В 1916 году (к этому времени уже стали известны основные черты электронной структуры атомов) немецкий учёный В. Коссель предположил, что при взаимодействии двух атомов один из них отдаёт электроны, а другой принимает; при этом первый атом превращается в положительно заряженный ион, а второй – в отрицательно заряженный. Электростатическое притяжение образовавшихся ионов приводит к образованию устойчивого соединения. Дальнейшее развитие идей Косселя привело к созданию современных представлений об ионной связи.
Недостатки теории Косселя:
Объяснялось образование химической связи только для соединений, состоящих из атомов с разной (противоположной) электроотрицательностью.
Теория ионной связи не объясняла образование химической связи между атомами с одинаковой или близкой электроотрицательностью.
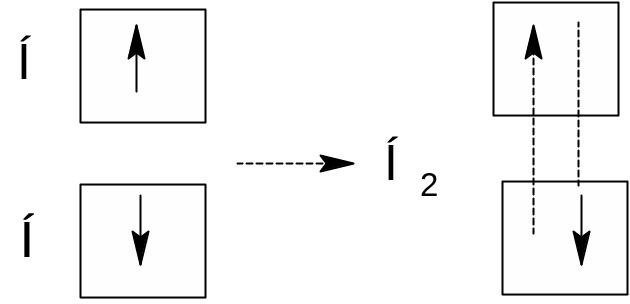
В том же 1916 году американский физико-химик Дж. Льюис высказал предположение, что химическая связь возникает в результате образования электронной пары, одновременно принадлежащей двум атомам. Эта идея послужила исходным пунктом для разработки современной теории ковалентной связи.
Процесс спаривания электронов при образовании молекулы водорода может быть изображён следующей схемой:
2. Квантово-механическая теория химической связи
Описание химической связи – это описание распределения электронной плотности в молекуле.
Существуют 2 способа описания химической связи:
– метод валентных связей,
– метод молекулярных орбиталей.
Представления о механизме образования химической связи, развитые на примере молекулы водорода, были распространены и на более сложные молекулы. Разработанная на этой основе теория химических связей получила название метода валентных связей (метод ВС).
В основе метода валентных связей лежит положение о том, что любая ковалентная химическая связь возникает в результате взаимодействия двух электронов с противоположно направленными спинами, причём изначально эти электроны принадлежат различным атомам, а образующаяся общая электронная пара – обоим атомам. Такой механизм образования ковалентной связи называется обменным механизмом. Именно по обменному механизму образованы химические связи в молекулах водорода и хлороводорода:
![]()
Согласно методу ВС ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
При образовании химической связи происходит уменьшение общей энергии системы:
А + В → АВ
Е1 Е2 Е3
Е1 + Е2 > Е3
Введем понятие валентность.
Валентность – это способность атомов образовывать химические связи.
Например: водород Н – валентность 1, гелий Не – 0.
Валентность атомов может совпадать с числом неспаренных электронов в основном состоянии (состоянии покоя)
Валентность может и не совпадать с числом неспаренных электронов в основном состоянии:
4Ве 1S22S22p0

Такому состоянию соответствует нулевая валентность, но если подвести энергию Е=250 кДж/моль, то валентность будет равна 2.

Данный переход возможен благодаря тому, что при образовании у Ве 2-х химических связей выделилась энергии больше, чем ушло на возбуждение атомов.
Например, у 2Не 1S2 данный переход не выгоден.

Данный переход не выгодный, поэтому что гелий (Не) сохраняет нулевую валентность.
Бор: 5В 1S22S22p1, валентность равна 3.

Углерод: 6С 1S22S22p2, в основном состоянии углерод имеет валентность 2, а в возбужденном состоянии – 4, т.е.


Хлор: 17Cl, 3S23p5, в основном состоянии углерод имеет валентность 1, а в возбужденном состоянии – 3, 5, 7.

Переходы электронов при возбуждении атомов возможны только в пределах энергетического уровня, без изменения главного квантового числа.
Метод молекулярных орбиталей.
В этом методе молекулы рассматриваются как единое целое, а электроны, принадлежащие всей молекуле в целом. Состояние электронов описывается молекулярными орбиталями.
Типы химических связей и их свойства.
Химическая связь – это совокупность сил, удерживающих атомы или ионы в молекулах и кристаллах.
В зависимости от характера распределения электронной плотности относительно ядер различают следующие типы химических связей: ковалентная, ионная, металлическая и водородная.
