
- •2. Квантово-механическая теория химической связи
- •Типы химических связей и их свойства.
- •3.1 Ковалентная связь
- •1) Обменному, когда каждый из соединяющихся атомов имеет на валентном уровне неспаренный электрон, который он предоставляет для образования общей электронной пары;
- •2) Донорно-акцепторному, когда один из соединяющихся атомов предоставляет электронную пару, а другой — вакантную орбиталь, на которой она может разместиться.
- •Параметры химической связи
Параметры химической связи
Параметрами, характеризующими химическую связь являются ее энергия, длина, полярность, поляризуемость и направленность.
Рассмотрим важнейшие параметры, характеризующие химическую связь.
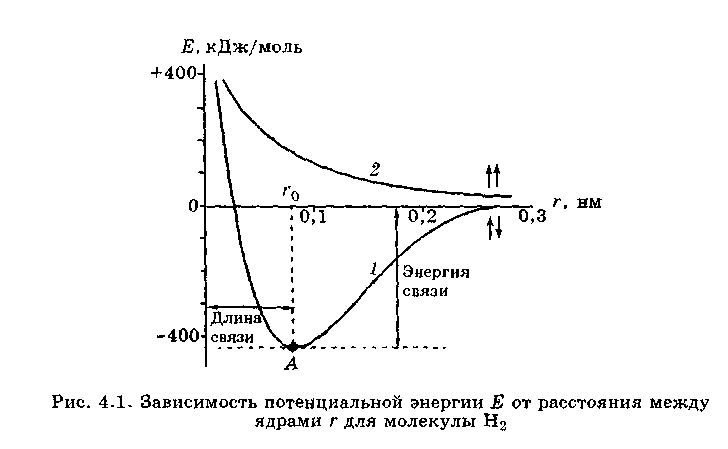
Энергия связи. Химическая связь возникает только в том случае, если при сближении атомов полная энергия системы понижается, т.е. энергия системы двух атомов, связанных химической связью, ниже энергии системы тех же атомов, не связанных между собой. Понижение энергии происходит вследствие перекрывания электронных облаков неспаренных электронов, принадлежащих двум соединяющимся атомам. Чем больше перекрывание, тем больше понижение энергии системы.
Энергия, которая выделяется при образовании химической связи между двумя атомами. Называется энергией связи между этими атомами. На рисунке энергия связи соответствует точке А.
Энергия связи численно равна энергии, которую нужно затратить на разрыв данной ХС, поэтому энергия связи – главная характеристика, являющаяся мерой прочности связи. Чем больше энергия связи, тем прочнее данная связь. Например, при образовании 1 моль молекул водорода из свободных атомов выделяется 436 кДж энергии. Эта величина характеризует прочность связи между атомами водорода в молекуле.
Длина связи.
Длина связи –это среднее расстояние между центрами связанных между собой атомов. Это расстояние соответствует минимуму энергии системы. Из сопоставления величины орбитального радиуса атома водорода (0,053 нм) и длины связи в молекуле (0,074 нм) видно, что при образовании ХС (H − H) происходит частичное перекрывание орбиталей атомов H. А поскольку химическую связь можно представить как стягивание ядер атомов повышенной электронной плотностью в области перекрывания орбиталей, то (в соответствии с законом Кулона) чем меньше длина связи (т.е. меньше атомные радиусы) и больше заряды ядер, тем прочнее связь.
Полярность связи. Полярность связи – это степень смещения электронной плотности (в области перекрывания орбиталей) к одному из атомов.
Если молекула образована двумя атомами с близкими значениями электроотрицательности, то распределение отрицательного заряда общего электронного облака более или менее симметрично. В предельном случае, если молекула образована двумя одинаковыми атомами, то отрицательный заряд электронов распределяется между ними поровну. В этом случае возникающая в молекуле связь неполярна. Если соединяются два атома с различными значениями электроотрицательности, то облако отрицательного заряда общей электронной пары смещается в сторону более электроотрицательного атома, а образующаяся связь является полярной.Это смещение тем значительнее, чем больше разность электроотрицательности элементов, образующих связь. При прочих равных условиях, чем больше полярность связи, тем больше ее энергия и, следовательно, меньше длина.
Поляризуемость связи. Поляризуемость связи – это способность связи перераспределять электронную плотность между атомами под действием соседних групп атомов или окружающей среды.
Например, связь в молекуле хлорида водорода под действием диполей воды поляризуется до полной диссоциации HCl , т. е. распада молекул на ионы. В то же время HF, несмотря на большую полярность связи, диссоциирует в воде лишь частично вследствие слабой поляризуемости связи из-за малого радиуса фтора.
Направленность связи
Образование ковалентной связи, являющееся результатом перекрывания валентных электронных облаков взаимодействующих атомов, возможно только при определённой взаимной ориентации электронных облаков. При этом область перекрывания располагается в определённом направлении по отношению к взаимодействующим атомам. Иначе говоря, ковалентная связь обладает направленностью.
Сигма-связь осуществляется при перекрывании облаков вдоль линии соединения атомов.
Пи-связь возникает при перекрывании электронных облаков по обе стороны от линии соединения атомов.
Делъта-связъ обязана перекрыванию всех четырех лопастей (d-электронных облаков, расположенных в параллельных плоскостях.
Исходя из условий симметрии, можно сказать, что электроны s-орбиталей могут участвовать лишь в σ -связывании, р-электроны — уже в σ - и π -связывании, -а d-электроны — как в σ - и π -, так и в δ -связывании. Для f-орбиталей способы перекрывания еще разнообразнее.
Как же неравноценные по исходному состоянию электроны образуют равноценные химические связи? Ответ на этот вопрос дает представление о гибридизации валентных орбиталей. Согласно этому представлению химические связи формируются электронами не "чистых", а "смешанных", так называемых гибридных орбиталей. Последние являются результатом смешения атомных орбиталей. Иначе говоря, при гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой, но уже одинаковой формы и одинаковой энергии.
Следует отметить, что, как физический процесс, гибридизация орбиталей не существует. Теория гибридизации представляет собой удобную модель наглядного описания молекул.
