
- •Введение
- •Глава 1. Физико-химические основы процессов химико-термической обработки
- •После преобразования получим
- •Путем вычитания получим
- •Для легирующего элемента решение этой же системы дает
- •Глава 2. Цементация стали
- •§ 1. Карбюризаторы для цементации
- •§ 2. Стали для цементации
- •§ 3. Влияние времени, температуры и легирующих элементов в стали на результаты цементации
- •§ 4. Режимы термической обработки стали после цементации и структра цементованного слоя
- •§ 5. Свойства цементованной стали.
- •Глава 3. Азотирование стали
- •§ 6. Технология азотирования
- •§ 7. Стали, подвергаемые азотированию
- •§ 8. Влияние параметров азотирования и легирования стали на скорость процесса газового азотирования. Структура азотированного слоя
- •§ 9. Свойства азотированной стали
- •Глава 4. Нитроцементация и цианирование стали
- •§ 10. Высокотемпературная нитроцементация
- •§ 11. Низкотемпературная нитроцементация
- •§ 12. Цианирование стали
- •Глава 5. Хромирование стали
- •§ 13. Технология процесса хромирования
- •§ 14. Структура хромированного слоя. Влияние различных факторов на результаты хромирования
- •§ 15. Свойства хромированной стали
- •Глава 6. Алитирование стали
- •§ 16. Технология процесса алитирования
- •§ 17. Структура алитированного слоя и влияние различных факторов на результаты процесса
- •§ 18. Свойства алитированной стали
- •Список литературы
Глава 1. Физико-химические основы процессов химико-термической обработки
Процессы химико-термической обработки включают три основные стадии: процессы, протекающие во внешней среде, на границе металл — среда насыщения и процессы диффузии в глубь металла.
При наличии газовой смеси, используемой для насыщения, процессы, протекающие во внешней среде, характеризуются гомогенными обменными реакциями между компонентами этой смеси
Н2О + СО = СО2 + Н2; (1)
СН4 + Н2О = СО + ЗН2, (2)
идущими при газовой цементации, или реакциями ассоциации
2H2 + О2 = 2Н2 О; (3)
3H2+N2=2NH2. )
Реакция (4) характерна для процесса азотирования. При наличии жидких солевых растворов также протекают гомогенные реакции типа
2NaCN +О2=2NaCNO; (5)
BaCl2 + 2NaCN = 2NaCl + Ba (СМ)2; (6)
Na2B4O7= Na2О + 2В2О3 (7)
(первые две реакции протекают в процессе цианирования, последняя — борирования).
При наличии твердых смесей, применяющихся для насыщения, также протекает ряд химических реакций, однако уже в этом случае они в основном являются гетерогенными по своей сущности, так как идут на поверхности твердых частиц:
СО2+Ств=2СО; (8)
6НС1 + 2А1 = 2А1С1з + ЗНз (9)
и далее
А1С1з+2А1=3А1С1. (10)
Реакция (8) характерна для цементации в твердом карбюризаторе, содержащем древесный уголь; реакции (9) и (10) являются промежуточными в процессе алитирования в твердых смесях алюминий (ферроалюминий) —хлористый аммоний NН4Cl.
При наличии многокомпонентных смесей вероятность протекания каждой из возможных реакций определяется, как известно, сравнительным уровнем свободной энергии Гиббса G; наиболее вероятна та реакция, которая имеет минимум свободной энергии.
Если рассмотреть состояние реакции, при котором реагенты и продукты реакции находятся в равновесии друг с другом, то константа равновесия (постоянная величина для данной температуры), в частности реакции (1), выражается как
К=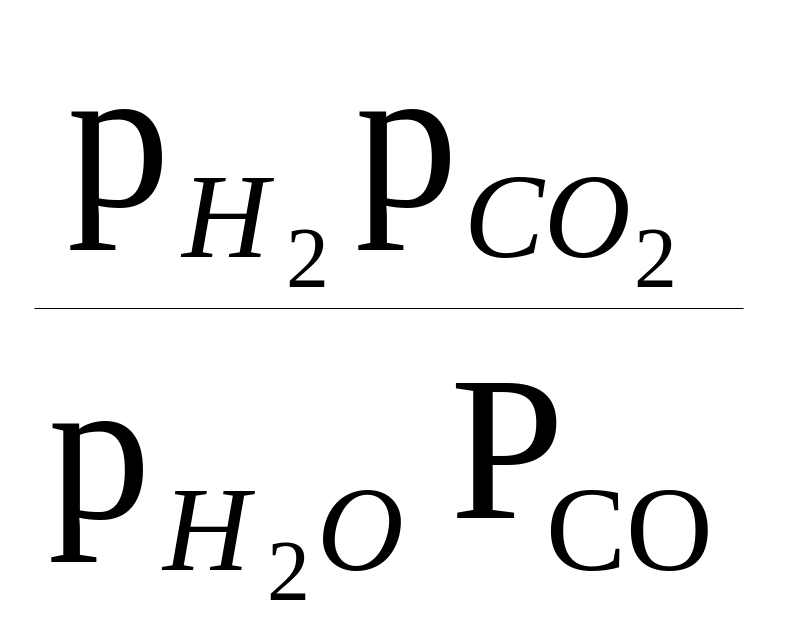
или
К=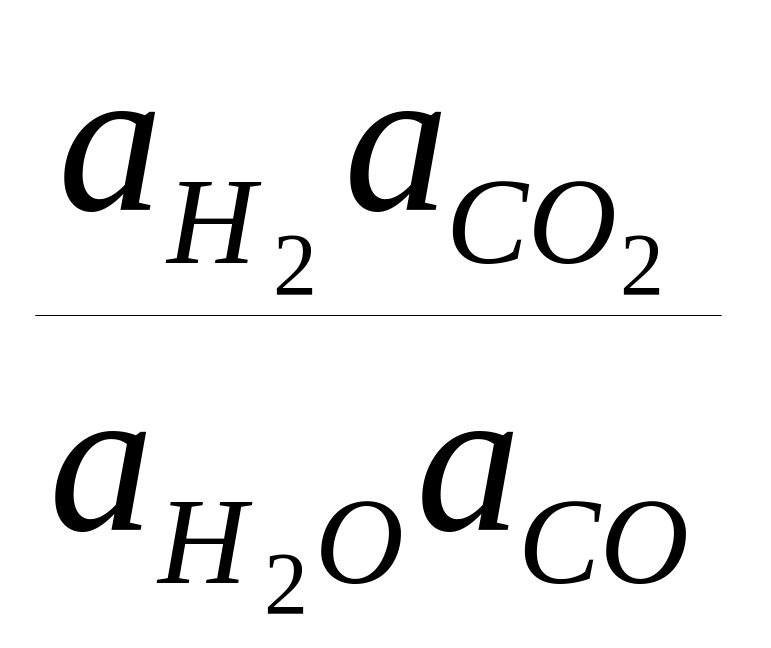
где а — термодинамическая активность компонента смеси, откуда
G= - RTlnK.
Скорость реакции определяется скоростью уменьшения концентрации реагирующих веществ, которая для реакций первого порядка при постоянной температуре пропорциональна концентрации, т.е.
v=-dC/dt=kC
где k-константа скорости реакции, температурная зависимость которой выражается в виде уравнения Аррениуса
k=k0exp(-Q/RT),
где Q-энергия активации реакции.
Для реакции второго порядка
v= - dC/dt = kCaCb при Са=Св, v=kC2.
Таким образом, процессы во внешней среде при химико-термической обработке определяются термодинамикой и кинетикой химических реакций.
Рассмотренные реакции, протекающие вне непосредственной зоны поверхности насыщаемой детали, казалось бы, являются только побочными или промежуточными, однако в целом ряде случаев они все же существенно влияют на дальнейшее протекание процесса. Если они являются промежуточными и эта стадия является лимитирующей для всех имеющие место реакций, то это отрицательно сказывается на кинетике всего процесса насыщения в целом; поэтому для того, чтобы ускорить эти реакции, в твердые смеси, например, вводят добавки-активаторы, усиливающие процессы катализа во внешней среде. В газовых смесях обычно рассмотренные гомогенные реакции все же чрезвычайно быстрые из-за достаточно быстрой взаимной диффузии в газах. Однако это же является причиной того, что футеровка печей, материал муфелей печей может воздействовать, и чрезвычайно активно, на газовую фазу. В частности, металлический муфель может служить катализатором для протекания уже не гомогенных, а гетерогенных реакций типа (4), (8), снижая тем самым общую концентрацию активных атомов (ионов) тех компонентов, которые далее взаимодействуют с поверхностью. Шамотная пористая кладка печей, содержащая адсорбированные газы, и подсосы воздуха также оказывают чрезвычайно активное воздействие на изменение газовой фазы, приводя к окислительным процессам типа реакций (2), (3), (8) и выводя из внешней зоны химических реакций необходимые для дальнейшего насыщения компоненты.
Второй основной стадией является химическая реакция на самой поверхности металла с одновременной адсорбцией газов или металлов в виде атомов или ионов - хемосорбция.
Накопление вещества на поверхности вследствие ионного взаимодействия происходит вследствие стремления поверхностной энергии сделаться возможно меньше. Адсорбция положительна, если концентрация растворимого вещества на поверхности больше, чем в объеме, и отрицательная, если эта концентрация меньше. В частности, для реакции растворения молекулярного азота N22[N]pacтв, вследствие того, что
С=Н—ТS, получаем
Hраств=H1-H2;
Sраств=S1-S2.
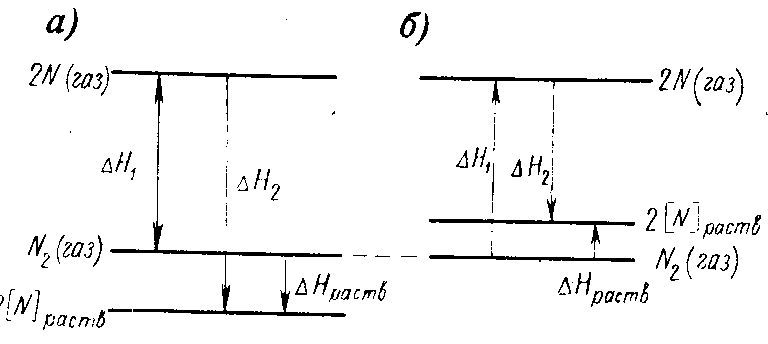
Рис. 1. Уровни энтальпии и изменения энтальпии при растворении азота
На рис. 1,а представлена диаграмма энтальпии, соответствующая случаю, когда образование раствора сопровождается уменьшением энтальпии и Нраств — отрицательная величина. Это означает, что во время растворения Na при постоянной температуре и давлении выделяется тепло. На рис. 1,6 показан случаи десорбции.
Связь между величиной адсорбции Г и поверхностным натяжением с, представляющим избыток свободной энергии на 1 см2 поверхностного слоя, представляется уравнением Гиббса в виде
Г=-![]()
где — химический потенциал данного компонента
i=0+RTln
ai,
di
=RT![]()
