
- •522 Список літератури
- •Розвиток тимчасових і постійних зубів
- •Розвиток тимчасових зубів
- •Розвиток постійних зубів
- •Будова дентину
- •Будова цементу
- •Анатомічна будова тимчасових зубів
- •Анатомічна будова постійних зубів
- •Нижня щелепа
- •Фізичні методаї діагностики
- •Методи дослідження кісткової тканини щелепно-лицевої ділянки
- •Лабораторні методи дослідження
- •Захисні механізми ротової порожнини
- •Клініка, діагностика і диференційна діагностика карієсу тимчасових зубів
- •Карієс тимчасових зубів на стадії формування кореня
- •Карієс тимчасових зубів на стадії сформованого кореня
- •Клініка, діагностика, диференційна діагностика карієсу постійних зубів
- •Лікування карієсу у дітей Лікування карієсу тимчасових зубів
- •Лікування карієсу постійних зубів
- •Стоматологічні пломбувальні матеріали, що застосовуються в дитячій
- •Терапевтичній стоматологи
- •Стоматологічні цементи
- •Композиційні пломбувальні матеріали
- •Стоматологічні адгезиви (бонд-системи, або праймер-адгезивні системи)
- •Стоматологічні амальгами
- •Профілактика карієсу у дітей
- •Некаріозні ураження зубів
- •"Тетрациклінові" зуби
- •Флюороз (ендемічний флюороз)
- •Природжені вади розвитку твердих тканин зубів
- •Пульпіт тимчасових і постійних зубів Структура та функції пульпи
- •Пульпіт тимчасових зубів Етіологія і патогенез пульпіту у дітей
- •Класифікація пульпіту у дітей
- •Клінічна симптоматика пульпіту тимчасових зубів
- •Пульпіт постійних зубів Етіологія, патогенез, класифікація
- •Мал. 60. Класифікація пульпіту кмі (о.С. Яворська, л.І.Урбанович, 1961) 269
- •Клініка, діагностика і диференційна діагностика пульпіту постійних зубів у дітей
- •Лікування пульпіту постійних зубів у дітей
- •Періодонтит тимчасових і постійних зубів
- •Структура і функції періодонта
- •Етіологія і патогенез періодонтиту тимчасових і постійних зубів у дітей
- •Клініка періодонтиту тимчасових зубів
- •Клініка періодонтиту постійних зубів
- •Ендодонтія тимчасових зубів
- •Вибір методу лікування періодонтиту тимчасових зубів
- •Лікування гострого періодонтиту тимчасових зубів
- •Лікування хронічного періодонтиту тимчасових зубів
- •Ендодонтичні наконечники та інструменти для обробки кореневих каналів
- •Лікування гострого періодонтиту постійних зубів у дітей
- •Травматичні ушкодження зубів
- •Тактика під час лікування травм
- •Постійних зубів у дітей і. Пошкодження твердих тканин зуба та пульпи
- •II. Пошкодження тканин пародонта
- •III, IV. Пошкодження кістки, ясен, слизової оболонки
- •Травми тимчасових зубів у дітей
- •Ускладнення після травми тимчасових та постійних зубів
- •Анатомічні та морфологічні особливості тканин пародонта
- •Класифікація хвороб пародонта
- •Пародонтит
- •Генералізований пародонтит
- •Ідіопатичні хвороби з прогресуючим лізисом тканин пародонта (пародонтоліз)
- •Хвороби слизової оболонки ротової порожнини у дітей Особливості будови слизової оболонки ротової порожнини в дитячому віці
- •Класифікація хвороб слизової оболонки ротової порожнини
- •Пошкодження слизової оболонки ротової порожнини
- •Вірусні хвороби слизової оболонки ротової порожнини
- •Прояви гострих вірусних та інфекційних захворювань на слизовій оболонці ротової порожнини
- •Грибкові хвороби слизової оболонки ротової порожнини
- •Алергічні хвороби слизової оболонки ротової порожнини
- •Зміни слизової оболонки ротової порожнини при деяких системних захворюваннях
- •Зміни слизової оболонки ротової порожнини при специфічних хворобах
- •Хвороби губів (хейліти)
- •Стоматогенне вогнище інфекції та вогнищевозумовлені хвороби
- •Список літератури
Лабораторні методи дослідження
Для встановлення діагнозу, підтвердження етіологічної ролі збудника, визначення стану імунної системи додатково використовують лабораторні методи дослідження.
Цитологічний метод.Одним із способів морфологічного дослідження є цитологічний метод, який оснований на вивченні клітин, їх окремих структур і конгломератів. Метод використовують для діагностики захворювань слизової оболонки ротової порожнини і пародонта у динаміці, для контролю ефективності лікування, а також для виявлення пухлин щелепно-лицевої ділянки.
Інформативність цитологічного дослідження визначається пунктуальним виконанням головних правил взяття і виготовлення препаратів. За шляхом отримання матеріли для дослідження можна поділити на ексфоліативні, асніраційні та змиви (Е. Кимеле, 1984).
Ексфоліативний матеріал для дослідження можна отримати з поверхні ерозій, виразок, лейкоплакій та інших патологічних елементів, що розташовані на відкритих поверхнях (слизова оболонка, шкіра), а також операційного матеріалу. Аспіраційний матеріал отримують з лімфатичних вузлів, пухлин, осередків запалення та інших
91
патологічних утворень шляхом пункції, тобто аспіраційним способом. При патології пазухи верхньої щелепи проводять її промивання ізотонічним розчином натрію хлориду з наступним цитологічним дослідженням змиву.
Матеріали для цитологічного дослідження беруть таким чином:
— мазок-відбиток — знежирене спиртом сухе предметне скельце прикладають до попередньо підготовленої ділянки слизової оболонки в доступних рухомих ділянках;
— мазок-відбиток — стерильну учнівську гумку прикладають до поверхні патологічного вогнища, потім відбиток переносять на знежирене предметне скельце контактним способом;
— мазок-зішкряб — вміст поверхні патологічного вогнища беруть ватним тампоном, гладилкою, шпателем чи кюретажною ложечкою і наносять тонким шаром на сухе знежирене предметне скельце.
Після взяття матеріалу його фіксують і фарбують, для чого на поверхню підсушених на повітрі цитологічних препаратів наносять фіксуючу рідину Никифорова (на 20-30 хв) і фарбують за методами Романовського—Гімзи, Лейшмана, Грама. Отримані препарати вивчають у світловому мікроскопі під малим (7х6) і великим (7х60 і 10х90 з імерсією) збільшенням.
Форма та величина нормальних клітин епітелію залежать від їх приналежності до шару слизової оболонки ротової порожнини (базального, парабазального, проміжного і поверхневого). У цитологічних препаратах практично здорових людей у невеликій кількості виявляються лейкоцити, лімфоцити, макрофаги і бактерії.
Для цитологічного дослідження вмісту ясенної борозни ясенну рідину збирають за допомогою стерильних ниток, які готують з марлі. Після висушування ділянки обстеження нитки поміщають на дно борозни чи кишені тупим зондом з апроксимальної поверхні ^| зубів на 5-8 хв.
Після видалення нитки готують мазки-відбитки, фіксують їх, фарбують за Романовським—Гімзою і підраховують число клітинних елементів на 100 клітин (табл. 8).
Вміст пародонтальних кишень вивчають також за методом П. М. Покровського і М. С. Макарової в модифікації І. А. Бенюмової (1962).
92
Методи обстеження при стоматологічних захворюваннях у дітей Таблиця 8. Цитограма ясенних кишень (Г. М. Барер, Т.І.Лемецька, 1996)
Клітинні елементи в ясенній рідині (%) |
Інтактний пародонт |
Гінгівіт |
Пародонтит |
Нейтрофіли |
2,2+0,2 |
83,0±4,9 |
80,7±2,4 |
Макрофаги |
- |
0,23±0,01 |
1,9±0,15 |
Гістіоцити |
- |
3,0±0,3 |
5,8±0,21 |
Епітеліальні клітини |
4,2+0,3 |
9,4+0,9 |
9,1±0,5 |
Стан процесів кератинизації слизової оболонки ротової порожнини характеризують індексом кератинізації (ІК), який визначають за формулою:
![]()
де ео — кількість зроговілих клітин епітелію, е — загальна кількість клітин епітелію.
Збільшення ступеня кератинізації свідчить про явища гіперке-ратозу (при лейкоплакії та ін.), зменшення — про підвищену десквамацію епітелію, зростання проникності слизової оболонки ротової порожнини для збудників захворювань та алергенів і, таким чином, про пригнічення неспецифічих захисних механізмів.
Для визначення стану захисних реакцій тканин пародонта, ступеня фагоцитозу і характеру реакції запалення використовують метод еміграції лейкоцитів у ротову порожнину (метод Ясиновського). Для взяття матеріалу використовують спосіб полоскання рота 10 мл ізотонічного розчину натрію хлориду протягом ЗО сек (перші три порції спльовують, наступні три збирають у пробірки для дослідження). Змиви у розведенні 1: 9 ретельно перемішують, підфарбовують 1% водним розчином трипанового синього і 1% водним розчином конго червоного (по 1 краплі). Піпеткою заповнюють спеціальну камеру. Через 5-10 хв після осідання лейкоцитів виконують підрахунки у 10 полях зору з урахуваннях живих і мертвих лейкоцитів, а також клітин плоского епітелію за показниками (М. Ф. Данилевський і співавт., 1993): середнього числа лейкоцитів в одному полі зору (живих і мертвих окремо) і клітин плоского епітелію; кількості лейкоцитів, які емігрували в 1 мл змивної рідини за Ясиновським.
93
Для визначення якісної характеристики клітинних елементів змиву з осаду готують мазки, фіксують їх в етиловому спирті, фарбують за Романовським-Гімзою і підраховують відносну кількість (на 100 клітин) незмінених і змінених нейтрофільних лейкоцитів, фагоцитів і лімфоцитів, а також проводять диференціацію епітеліальних клітин за ступенем зрілості. У нормі 80% лейкоцитів, що емігрували до ротової порожнини, життєздатні, рухливі і спроможні до фагоцитозу протягом 2,5 год.
Мікробіологічні методи дослідження. На слизовій оболонці ротової порожнини внаслідок контактування з навколишнім середовищем із перших хвилин життя відбувається бактеріальна колонізація, тобто формується система мікробіоценозу. Мікрофлора ротової порожнини є найбільш інформативним показником — "індикатором" стану місцевої та загальної неспецифічної і специфічної резистентності як організму в цілому, так і ротової порожнини зокрема (Є. В. Боровський, В. К. Леонтьєв, 1991).
На слизовій оболонці ротової порожнини людини міститься найбільша кількість мікроорганізмів порівняно з іншими порожнинами. Кількість видів бактерій (аеробних і анаеробних) коливається від 100 до 160. Усі види мікроорганізмів можна умовно поділити на дві групи:
1-ша — транзиторні (такі, що потрапляють до рота з їжею, водою, повітрям і мають обмежений час перебування); 2-га — резидента! (такі, що створюють екосистему слизової оболонки). Останні у свою черіу поділяються на симбіонтні та умовно-патогенні (непостійні).
Симбіонтна мікрофлора бере участь у процесі травлення, обміні речовин, синтезі вітамінів, формуванні імунного статусу і загальної неспецифічної резистентності. Представники умовно-патогенної мікрофлори характеризуються потенціальною патогенністю, яка реалізується при створенні особливо сприятливих умов для їх розвитку (імунодефіцити! стани, хвороби, стреси, травми, оперативні втручання тощо) шляхом досягання критичної маси мікроорганізмів, здатних спричинити захворювання. Патогенними вважаються мікроорганізми, які є збудниками захворювань.
Під впливом загальних механізмів функціонування екосистем у живій природі (кліматичних, джерел харчування, ґрунтових та ін.) мікробіоциноз слизової оболонки ротової порожнини змінюється
94
Методи обстеження при стоматологічних захворюваннях у дітей
протягом доби, сезону, року. На формування резидентної флори ротової порожнини впливають конкретні фізіологічні (генетичне детерміновані і набуті) властивості організму, в першу чергу стан системи місцевого імунітету.
Можна визначити п'ять головних ареалів мікробіоцинозу слизової оболонки ротової порожнини: слина; зубні бляшки; каріозні порожнини; ясенні борозни і спинка язика.
Кількість мікроорганізмів у 1 мл слини в середньому становить 750 млн., а в 1 г проб із зубної бляшки і ясенної борозни у 100 разів вища, тобто досягає 200 млрд. (Є. В. Боровський, В. К Леонтьєв, 1991). Резидентна мікрофлора ротової порожнини представлена майже ЗО видами мікроорганізмів (табл.9). У різних зонах ротової порожнини переважає певний вид мікроорганізмів (Str. mutans — на поверхні зубів, Str. salivarius — на язиці і в слині, В. melanino-genicus — у ясенній борозні).
Мікробіологічне дослідження дозволяє визначити видовий склад мікрофлори слизової оболонки ротової порожнини, встановити їх кількісну характеристику та виявити чутливість умовно-патогенних і патогенних видів мікроорганізмів до антибактеріальної терапії.
Взяття матеріалу для мікробіологічного дослідження здійснюють стерильним ватним тампоном чи турундою з пародонтальної кишені. Ясенну рідину отримують за допомогою капілярних трубочок чи фільтрувального паперу. Далі тампон (турунду, фільтрувальний папір) промивають у 10 мл ізотонічного розчину натрію хлориду, отримують суспензію мікроорганізмів і здійснюють її посів на спеціальні живильні середовища. Після вирощування культури і її ідентифікації підраховують кількість колоній і визначають їх чутливість до антибіотиків.
Зміни складу мікрофлори слизової оболонки ротової порожнини умовно поділяють на 4 категорії (В. В. Хазанова і співавт., 1996):
дизбіотичне зрушення (латентна або компенсова форма); дизбактеріоз І-ІІ ступеня (субкомпенсована форма); дизбактеріоз III ступеня; дизбактеріоз IV ступеня.
Особливостями дизбіотичного зрушення є незначні зміни мікробіоцинозу слизової оболонки ротової порожнини у вигляді підвищення кількості одного виду умовно-патогенної мікрофлори у допоро-
95
Таблиця 9. Мікрофлора ротової порожнини в нормі (Є.В.Боровський, В.К.Леонтьєв, 1991)
Мікроорганізми |
У слині |
У зубоясенних кишенях (частота виявлення,%) |
|
Частота виявлення |
Кількість в 1 мл |
||
Група А. Резидентна флора 1. Аероби і факультативні анаероби: |
|||
Str. mutans |
100 |
1,5'х10 |
100 |
Str. salivanus |
100 |
10' |
100 |
Str. mitis |
100 |
ІО'-ІО' |
100 |
Сапрофітні нейсерії' |
100 |
10'-10' |
++ |
Лактобактерп |
90 |
Ю'-Ю4 |
+ |
Стафілококи |
80 |
10'-10' |
++ |
Дифтероіди |
80 |
He визначено |
+ |
Гемофіли |
60 |
-"- |
0 |
Пневмококи |
60 |
-"- |
Не визначено |
Інші коки |
30 |
10'-10' |
++ |
Сапрофітні мікобактерії |
++ |
He визначено |
|
Тетракоки |
++ |
-"- |
++ |
Дріжджоподібні гриби |
50 |
Ю'-Ю1 |
+ |
Мікоплазми |
50 |
ю'-ю3 |
Не визначено |
Найпростіші: |
|||
Entamoeba gmgivalis |
0 |
о |
45 |
Trichomonas clongata |
0 |
о |
25 |
11. Облігатні анаероби |
|||
Вейлонели |
100 |
ІО'-ІО" |
100 |
Анаеробні стрептококи (пептострептококи) |
100 |
Не визначено |
100 |
Бактераіди |
100 |
-"- |
100 |
Фузобактерп |
75 |
10'-10" |
100 |
Ниткоподібні бактерії |
100 |
Ю'-Ю" |
100 |
Актиноміцети і анаеробні дифтероїди |
100 |
Не визначено |
++ |
Спірули і вібріони |
++ |
-"- |
++ |
Спірохети (сапрофітні боррелії', трепонеми і лептоспіри) |
-+ |
-"- |
100 |
96
Методи обстеження при стоматологічних захворюваннях у дітей Продовження таблиці 9
Група Б. Непостійна флора І. Аероби і факультативні анаероби Грамнегативні палички: |
|||
Klebsiela |
15 |
10-102 |
0 |
Esherichia |
2 |
10-102 |
+ |
Aerobacter |
3 |
He визначено |
0 |
Pseudomonas |
-+ |
-"- |
0 |
Proteus |
-+ |
-"- |
0 |
Alkali genes |
-+ |
-"- |
0 |
Бацили |
-+ |
-"- |
0 |
II. Облігатні анаероби |
|||
Клостридії |
-+ |
He визначено |
0 |
Clostridium putrificum |
-+ |
-"- |
0 |
Clostridium perfringens |
+ |
-"- |
0 |
Примітка ++- виявляються часто, +- виявляються не дуже часто, -+ - виявляються рідко, 0 - не виявляються
говій кількості при збереженні нормального видового складу мікрофлори ротової порожнини та відсутності виражених клінічних ознак захворювання.
Дизбактеріоз слизової оболонки ротової порожнини І-ІІ ступеня характеризується виявленням двох-трьох умовно-патогенних видів мікроорганізмів на тлі зменшення кількості симбіонтної мікрофлори та наявністю клінічних ознак захворювання.
Дизбактеріоз слизової оболонки ротової порожнини III ступеня характеризується виявленням патогенної монокультури у значній кількості при значному зниженні чи повній відсутності представників симбіонтної мікрофлори, вираженістю клінічних ознак захворювання.
Діагноз дизбактеріозу IV ступеня встановлюється на підставі виявлення асоціації грибів роду Candida з патогенними видами бактерій та клінічних ознак захворювання.
При дизбактеріозі слизової оболонки ротової порожнини I-IV ступеня доцільно провести бактеріологічні дослідження кишечника для встановлення характеру обсіменіння умовно-патогенною і патогенною мікрофлорою і визначення методів лікування (санації).
97
Для визначення ризику виникнення карієсу використовується ще один мікробіологічний метод — встановлення титру лактобактерій ротової порожнини (Г. Д. Овруцький, В. К. Леонтьєв, 1986). Для дослідження використовують змішану слину, яку спльовують у пробірку. Після центрифугування протягом 10 хв з неї готують декілька поступових розведень в ізотонічному розчині натрію хлориду до 9-10. Із кожного розведення беруть 0,5 мл розчину і висівають його на живильні середовища. Посівний матеріал поміщають у термостат за температури 37 °С на 48 год. Потім під бінокулярною лупою підраховують число колоній на агарових пластинках, визначають максимальне розведення. Логарифмічний показник граничного розведення, що дав ріст, приймають за титр лактобактерій. При рості лактобактерій у розведенні більш ніж 10 спостерігається інтенсивний розвиток карієсу зубів.
Біохімічні методи дослідження. Для вивчення характеру гомеостазу ротової порожнини, визначення факторів ризику виникнення захворювань зубів, пародонта та слизової оболонки ротової порожнини використовують біохімічні методи дослідження. Кількісний та якісний склад слини є досить сталим показником (табл. 10). Вміст мінеральних речовин і мікроелементів варіює (табл. 11). Значні біохімічні зміни одного або кількох показників можуть свідчити про наявність патологічного процесу. Так, при хронічних захворюваннях слинних залоз, калькульозному сіалоаденіті, а також при патологічних станах, що супроводжуються зневодненням організму значно зменшується кількість слини і швидкість її виділення, а її щільність і в'язкість зростають. При гострих інфекційних захворюваннях, виснажливих хронічних хворобах значно змінюється склад білкових фракцій слини.
Морфологічні методи дослідження. Морфологічні методи дослідження використовуються для підтвердження або встановлення діагнозу хвороб з неясною клінікою (при хронічних запальних, гіпер-пластичних чи пухлинних процесах); визначення стадії розвитку процесу; підтвердження ефективності лікування.
Для здійснення морфологічних досліджень користуються біопсією як методом отримання матеріалу. При проведенні обстеження використовують місцеву чи провідникову анестезію. Тканини для біопсії (розміром 3-5 мм з підслизовим шаром) отримують за допо-
Методи обстеження при стоматологічних захворюваннях у дітей Таблиця 10. Кількісний та якісний склад змішаної слини (М. В. Семенов,1968)
Показник |
Середнє значення і діапазон коливань |
Кількість на добу |
1400,0-1500,0 |
Швидкість виділення, мл/хв |
0,1-1,8(0,57) |
Щільність, г/см3 |
1,002-1,020 5,6-7,6(6,75) |
В'язкість за 38 "С |
22-23 |
Вода,% |
99,14-99,42 |
Щільні речовини, % |
0,58 - 0,86 (386-860 мг/100 мл) |
Гази слини, % |
|
Кисень |
0,5-0,8 |
Вуглекислий газ |
8,0 - 44,0 |
Азот |
0,9-1,0 |
Загальний білок, мг/100 мл |
|
Альбуміни, % |
242,0 |
Глобуліни, % |
7,6 |
- |
11,1 |
- |
43,3 |
- |
18,5 |
Лізоцим, мг/100 мл |
18,1 |
Муцин, мг/100 мл |
270,0 |
Кисла фосфатаза, мг/мл |
22,0-23,8 |
Лужна фосфатаза, мг/мл |
5,5-6,0 |
могокї ножиць, скальпеля чи спеціальних інструментів або шляхом пункції. Рану після біопсії зашивають. Біопсійний матеріал кладуть у пробірку з фіксуючим розчином і направляють для дослідження. У супровідному документі вказують дату здійснення дослідження, ім'я та вік пацієнта, локалізацію патологічного процесу, коротку клінічну характеристику захворювання і попередній діагноз.
Таблиця 11. Вміст мінеральних речовин і мікроелементів у змішаній слині (В. Є. Зайчик, Ш. Т. Багіров, 1991)
Показник |
Середнє значення |
Діапазон коливань |
Кальцій, мкг |
37 |
5-86 |
Фосфор, мкг |
153 |
29 - 384 |
Натрій, мкг |
51,5 |
15,7-137,8 |
Калій, мкг |
416 |
94-1102 |
Мідь, нг |
116 |
28-378 |
Магній, мкг |
7,9 |
1,2-16,8 |
Хлор,мкг |
228 |
76-621 |
Хром,нг |
6,7 |
0,6 - 22,8 |
Марганець,нг |
9,5 |
1,8-41 |
Залізо, нг |
607 |
215-1500 |
Селен,нг |
3,6 |
0,7-9,5 |
Цинк,нг |
469 |
187-1230 |
Методи дослідження периферичної крові. Патологічні процеси, що відбуваються в ротовій порожнині, незважаючи на їх локальність, відображуються на загальному стані організму. Для виявлення характеру порушення гомеостазу використовують показники гемостазу (табл. 12), методи дослідження периферичної крові (табл. 13), визначають результати біохімічних досліджень (табл. 14).
Методи діагностики алергічних станів. Діагноз алергічних захворювань оснований на комплексному обстеженні хворого з використанням алергологічних, спеціальних і загальноклінічних методів дослідження (В. М. Сидельников і співавт., 1985). Особлива увага при цьому приділяється ретельному збору алергологічного анамнезу.
Алергологічний анамнез складається з отримання даних щодо наявності у родоводі хворого (пробанда) алергічних захворювань;
антенатального періоду розвитку (гестозу вагітних, нераціонального харчування — зловживання цитрусовими, переїдання, переважання білкової їжі тощо), професійної шкідливості, лікування, бактеріаль-
100
Методи обстеження при стоматологічних захворюваннях у дітей Таблиця 12. Показники гемостазу у дітей (В. М. Сидельников, 1994)
Показник |
Норма |
Гіпо-коагуляція |
П пер-коагуляція |
Час згортання, хв |
5432 |
10 9 8 7 6 |
10 |
Час рекальцифікації плазми, сек |
120 90 60 |
270 240 210 180 150 |
300 |
Протромбіновий індекс,% |
80 90 100 110 |
0 10 20 30 40 50 60 70 |
120 130 |
Тромбіновий час,сек |
10 9 |
13 12 11 |
8 7 |
Фібринолітична активність, % |
17 16 15 |
23 22 21 20 19 18 |
14 13 12 11 |
Ретракція згустка,% |
60 70 80 |
0 10 20 30 40 50 |
90 100 |
Тромбоцити |
^OxIO'^OOxlO'BiA |
|
|
них і вірусних захворювань; розвитку і вигодовування дитини на 1-му році життя (перебігу пологів і періоду новонародженості, характеру перенесених захворювань, вигодовування, часу появи ексудативно-катарального діатезу і гіперчутливості до харчових алергенів тощо); виду і типу реакції на профілактичні щеплення; часу появи перших алергічних захворювань, тла, на якому вони виникли, його сезонності, зв'язку з певною ситуацією і потенціальними алергенами.
![]()
У здорових дітей показники індексу залежно від віку коливаються в межах 0,68-1,08 умовних одиниць. При алергізації показники ІА зростають у 2-4 рази.
Для діагностики алергічних захворювань використовують неспецифічні і специфічні тести (В. І. Яковлєва і співавт., 1986). До неспе-
101
Таблиця 13. Нормальний склад периферичної крові у дітей різного віку (П. С. Мощич, 1994)
Вік |
Еритро цити, 10"/л |
Гемоглобін, Г/Л |
Лейкоцити, Ю'/л |
Лейкоцитарна формула, % |
ШОЕ, |
||||
1 |
2 |
3 |
4 |
5 |
мм/год |
||||
1 рік |
4,67 |
129,2 |
10,5 |
32,0 |
54,5 |
11,5 |
1,5 |
0,5 |
7 |
1-2 роки |
4,82 |
127,5 |
10,8 |
34,5 |
50,0 |
11,5 |
2,5 |
0,5 |
8-7 |
2-3 роки |
4,76 |
132,6 |
11,0 |
36,5 |
51,5 |
10,0 |
1,5 |
0,5 |
8-7 |
3-4 роки |
4,83 |
129,2 |
9.9 |
38,0 |
49,0 |
10,5 |
2,0 |
0,5 |
8 |
4-5 років |
4,89 |
136,0 |
10,2 |
45,5 |
44,5 |
9,0 |
1,0 |
0,5 |
8 |
5-6 років |
5,08 |
139,4 |
8,9 |
43,5 |
46,0 |
10,0 |
0,5 |
0,25 |
8 |
6-7 років |
4,89 |
136,0 |
10,6 |
46,5 |
42,0 |
9,5 |
1,5 |
0,5 |
10 |
7-8 років |
5,1 |
132,6 |
9,98 |
44,5 |
45,0 |
9,0 |
1,0 |
0,5 |
10 |
8-9 років |
4,84 |
137,7 |
9,88 |
49,5 |
39,5 |
8,5 |
2,0 |
0,5 |
10 |
9-Ю років |
4,9 |
136,0 |
8.6 |
51,5 |
38,5 |
8,0 |
2,0 |
0,25 |
10 |
10-11 років |
4,91 |
144,5 |
8.2 |
50,0 |
36,0 |
9,5 |
2,5 |
0,5 |
S |
11-12 років |
4,83 |
141,1 |
7,9 |
52,5 |
36,0 |
9,0 |
2,0 |
0,5 |
8 |
12-13 років |
5,12 |
132,4 |
8,1 |
53,5 |
35,0 |
8,5 |
2,5 |
0,5 |
8 |
13-14 років |
5,02 |
144,5 |
8,3 |
56,5 |
32,0 |
8,5 |
2,5 |
0,5 |
8 |
14-15 років |
4,98 |
146,2 |
7,65 |
60,5 |
28,0 |
9,0 |
2,0 |
0,5 |
8 |
Лршмлн.о 1 нейтрофільш гранулоцити, 2 -лімфоцити, З моноцити, 4 еозинофіли, 5 - базофіли
цифічних тестів належать підвищена кількість еозинофілів у секреті осередку запалення і в периферичній крові; тромбоцита- і лейкопенія до агранулоцитозу; підвищений вміст глобулінів у сироватці, особ-
102
Методи обстеження при стоматологічних захворюваннях у дітей Таблиця! 4. Головні показники крові у дітей у нормі (В. М. Сидельников,1994)
Склад крові |
Кількість в одиницях |
|
|
МКСА |
CI |
Залишковий азот |
20 - 40 мг % |
14,3-28,6 ммоль/л |
Аланжамінотрансфе-раза |
0,1-0,68 мкмоль/(годхмл) |
0,1-0,68 ммоль/(годхл) |
Амілаза (діастаза) |
80 120 ОД |
16-30г/(годхл) |
Аспартатамінотранс-фераза |
0,1-0,45 мкмоль/(годхмл) |
0,1-0,45 ммоль/(годхл) |
Лужна фосфатаза |
0,5-0,13 мкмоль/(годхмл) |
0,5 -1,3 ммоль/(годхл) |
Білок загальний |
6,5-8,5 г% |
65 - 85 г/л |
Білкові фракції сироватки |
||
Альбуміни |
55 - 70 % |
0,55-0,7 |
Глобуліни |
45 - 30 % |
0,45-0,3 |
Ал ьбу м і по глобул і -новий коефіцієнт |
1,3-2,3 |
|
Біл і рубі н загал ьн й й |
0,2 -1 мг % |
3,4-17,1 мкмоль/л |
Зв'язаний |
0,05-0,2 мг% |
0,85 - 3,4 мкмоль/л |
Вільний |
0,15-0,6 мг% |
2,56 - 10,3 мкмоль/л |
Холестерин |
150 250 мг% |
3,9-6,5 ммоль/л |
Креатин і н |
0,4-1,2 мг% |
0,035-0,106 ммоль/л |
Сечовина |
13-42 мг% |
2,1-7 ммоль/л |
Кальцій загальний |
10 -11 мг % |
2,52,73 ммоль/л |
Фосфор |
4 - 5 мг % |
1,29 -1,62 ммоль/л |
ливо (З-іу- глобулінів. Достовірність цих тестів коливається в межах 30-40%.
До специфічних тестів (таких, що сприяють виявленню сенсибілізації організму до певного алергену) належать шкірна та мукозна проби, клітинні тести ( реакція лейкоцитолізу, показник пошкоджуваності нейтрофілів, реакція агломерації лейкоцитів, індекс аглютинації тромбоцитів, реакція дегрануляції базофільних лейкоцитів та ін.).
103
Шкірні та мукозні проби виконують у спеціально обладнаних кабіненах медичних закладів за наявності набору медикаментів для надання невідкладної медичної допомоги та запобігання ускладненням.
Шкірні проби включають аплікаційні, крапельні, скарифікаційні і внутрішньошкірні. Їх використовують для раннього виявлення схильності до інтенсивних загальних реакцій анафілактичного характеру. Крапельні та аплікаційні проби вважають найменш чутливими, але найбільш безпечними. Крапельну пробу виконують таким чином:
на здорову ділянку передпліччя наносять 1-2 краплі розчину алергену (у спирті чи ізотонічному розчині натрію хлориду) або накладають зволожений у розчині алергену шматочок марлі розміром 1х1 см і покривають целофаном. Паралельно таким самим чином наносять тест-контрольну рідину. Результати крапельної проби оцінюють через 20-30 хв, 2, 4, 12, 24 год. У разі позитивної реакції з'являються гіперемія, набряк, пухирці. У разі появи печіння, свербіння на місці нанесення алергену пробу слід припинити, залишки алергену зняти ефіром чи спиртом.
Скарифікаційну пробу і пробу уколом здійснюють таким чином. Шкіру на передній поверхні передпліччя обробляють спиртом. Після її висихання наносяь краплі алергенів певної стандартної концентрації. Щоб виявити специфічну сенсибілізацію, використовують мікробні алергени, які мають одну шкірну дозу в 0,1 мл та неінфекційні (побутові, епідермальні, пилкові) алергени, які мають 10 000 PNU в 1 мл (PNU — одиниця білкового азоту, яка дорівнює 1х10 мг цієї речовини; П. С. Мощич і співавт., 1994). Паралельно виконують пробу з гістаміном у розведенні 1:10 000.
Скарифікатором чи ін'єкційною голкою (окремо для кожного алергену, тест-контрольної рідини чи гістаміну) здійснюють скарифікацію до 5 мм через кожну краплю чи вводять тонку голку через нанесені краплі алергену таким чином, щоб не пошкодити судини (В.М.Сидельников і співавт., 1985).
Інтенсивність реакції оцінюють шляхом вимірювання двох найбільших за діаметром гіперемії та припухлості і позначають системою плюсів (табл.15).
Внутрішньошкірну пробу виконують на передній поверхні одного чи обох передпліч. Для виявлення порогової дози беруть кілька розведень алергену (алергометричне титрування). Неінфекційні алер-
104
Методи обстеження при стоматологічних захворюватіях у дітей
Таблиця 15. Оцінка скарифікаційних проб з неінфекційними алергенами (П. С. Мощич, 1994)
Реакція |
Вираженість реакції |
Розміри місцевої реакції |
Негативна |
- |
Аналогічна контролю |
Сумнівна |
- |
Гіперемія без пухирця |
Слабко позитивна |
+ |
Пухир діаметром 2-3 мм, замітний при натягуванні шкіри |
Позитивна середнього ступеня |
++ |
Пухир діаметром не більше 5 мм, оточений гіперемією, чітко видимий без натягування шкіри |
Різко позитивна |
+++ |
Пухир діаметром не більше 10 мм з гіперемією |
Дуже різко позитивна |
++++ |
Пухир діаметром більше 10 мм з гіперемією і псевдоподіями |
Таблиця 16. Оцінка внутрішньошкірних проб з неінфекційними алергенами (П. С. Мощич, 1994)
Реакція |
Вираженість реакції |
Розміри місцевої реакції |
Негативна |
- |
Розміри такі самі, як у контролі |
Сумнівна |
|
Пухир розсмоктується повільніше, ніж у контролі |
Слабко позитивна |
+ |
Пухир діаметром 4-8 мм, оточений гіперемією |
Позитивна середнього ступеню |
++ |
Пухир діаметром 8-15 мм, оточений гіперемією |
Різко позитивна |
+++ |
Пухир діаметром 15-20 мм з псевдоподіями, оточений гіперемією |
Дуже різко позитивна |
++++ |
Пухир діаметром понад 20 мм з псевдоподіями, лімфангітом, додатковими пухирями по периферії та яскравою гіперемією |
105
гени (1:1000,1:100,1:10) в дозі 0,2 мл різними туберкуліновими шприцами уводять внутрішньошкірно маленькою голкою (В. Г. Передерій і співавт., 1995).
Вну грішньошкірну пробу вираховують через 20-30 хв (негайний тип) і 24-48 год (уповільнений тип) за параметрами, наведеними у табл.16.
Внутрішньошкірні проби високочутливі, але й небезпечні, через те, що можуть спричинити тяжку загальну алергічну реакцію. Після закінчення обстеження дитина повинна перебувати під наглядом лікаря не менш ніж ЗО хв.
Мукозні проби виконують для визначення підвищеної чутливості слизової оболонки ротової порожнини, найчастіше для визначення чутливості до пластмас, що їх використовують для базисів ор-тодонтичних пластинок і протезів. Для проведення проби використовують присоски і приставки для утримання на поверхні слизової оболонки розчину потенційного алергену. Результати оцінюють через ЗО хв за такою шкалою:
1 — + - гіперемія;
2 — ++ — гіперемія з припухлістю;
3 — +++ — гіперемія з маленькими пухирцями;
4 — ++++ — пухирі, що зливаються;
5 — +++++ — некроз;
Клітинні тести. Реакція лейкоцитолізу грунтується на пошкод-жувальному впливі бактеріальних алергенів на лейкоцити периферичної крові.
Для проведення реакції в центрифужні чи преципітаційні пробірки вносять по одній крашіі 3% розчину натрію цитрату, потім по три краплі крові, взятої з пальця хворого, перемішують і додають по краплі алергену (10 доз для шкіри в 0,1 мл). В останню пробірку (контрольну) вливають буферний розчин у тій же кількості. Пробірки обережно перемішують і витримують у термостаті протягом 1 год за гемператури 38 °С. З кожної пробірки готують три тонких мазки крові і фарбують їх за Паппенгеймом—Крюковим. Підраховують по 100 нейтрофілів у трьох мазках із кожної пробірки, в тому числі деформовані і зруйновані клітини.
Специфічний алерген деформує і руйнує 14% і більше нейтрофілів. Неспецифічна деформація (контроль) не перевищує 10%.
106
Методи обстеження при стоматологічних захворюванняху дітей
Оцінка тесту: слабко позитивна — більше ніж 14% розширених і деформованих нейтрофілів; позитивна — 25-34% розширених і деформованих нейтрофілів; різко позитивна — більше ніж 35% розширених і деформованих нейтрофілів; при неспецифічній деформації (контроль) до 10% розширених і деформованих нейтрофілів.
Реакція агломерації лейкоцитів проводиться таким чином. У дві парафіновані преципітовані пробірки вносять по 0,05 мл 3,8% розчину натрію цитрату, в дослідну пробірку — 0,025 мл цього самого розчину. Пробірки витримують у термостаті протягом 2 год за температури 37 °С. На предметне скельце наносять товсту краплю і висушують її на повітрі. Без попередньої фіксації її фарбують 0,01% розчином метиленового синього. Упрепаратах підраховують лейкоцити з урахуванням клітин, що утворюють групи з трьох і більше лейкоцитів (ступінь агломерації). Позитивною вважається реакція нри різниці між контролем і дослідом більше ніж 30%.
Реакція дегрануляції тканинних базофілів (сполучної тканини основана на здатності тканевих базофілів) викидати у навколишнє середовище гістамін і концентрувати його в гранулах. Для проведення реакції використовують сироватку крові хворого, перитонеальні тканеві базофіли криси, специфічний алерген рослинного чи харчового походження, контрольний (неспецифічний) алерген. Оцінка проводиться при мікроскопії препарата (х280) і перегляді 100 тканевих базофілів двох категорій — нормальних і дегранульовапих. Тест вважається негативним, якщо число дегранульованих клітин не перевищує 10%.
Імунологічні методи обстеження
Порушення імунного гомеостазу відіграють певну роль у патогенезі більшості стоматологічних захворювань. На сьогодні лабораторна практика має у своєму розпорядженні методи, завдяки яким можна оцінити стан різних ланок системи імунітету, в тому числі стан системних і місцевих неспеци-фічних факторів, а також інтенсивність специфічної імунної відповіді, яка виникає у відповідь на конкретний антигенний стимул.
Головною підставою для проведення імунологічного обстеження служить наявність клінічних проявів імунодефіциту або так зва-
107
них клінічних факторів-маркерів імунодефіцитних станів, серед яких слід виділити:
І. Генетичне детерміновані захворювання у сім' ї.
II. Наявність у найближчих родичів дитини хронічних запальних захворювань (тонзиліту, аденоїдиту, фарингіту, синуситу, гаст-родуоденіту, холецистохолангіту, панкреатиту, циститу, нефриту тощо, хронічних вірусних захворювань (рецидивуючого гер-песа, герпеса зостер та ін.), грибкових захворювань слизових оболонок, шкіри та її придатків, ендокринопатій чи захворювань ендокринної системи, алергічних захворювань, автоімунних захворювань, пухлин.
III. Вплив несприятливих чинників на перебіг вагітності і пологів:
проживання в екологічно несприятливому регіоні; професійні шкідливі чинники (лаки, фарби, хлор, аміак, антибіотики, шум, вібрація, магнітні поля тощо); стреси; захворювання на гострі інфекції чи рецидиви хронічних захворювань; використання препаратів з тератогенними чи невизначеними властивостями, а також антибактеріальних, гормональних чи імунодепресивних лікувальних засобів; гестози вагітності (І, II половини); резус-конфлікти; патологія пологів (кесарів розтин, інструментальні і ручні методи допомоги у пологах, передлежання плаценти, кровотеча, тривалий безводний період, пологова травма під час пологів, асфіксія); несприятливі чинники періоду новонародже-ності (недоношеність, незрілість, гіпотрофія плода, дистрес-син-дром, перинатальна енцефалопатія та ін.).
IV. Виявлення вад розвитку і стигм дизембріогенезу.
V. Вплив обтяжливих чинників протягом перших 12 міс життя:
раннє змішане чи штучне вигодовування; перенесені важкі захворювання (бронхіт чи бронхопневмонія, сепсис, остеомієліт, дитячі інфекційні захворювання у важкій формі, гострі кишкові інфекції та ін.); застосування у лікуванні антибіотиків, антигіста-мінних препаратів, гормонів кори надниркових залоз;
дизбактеріоз кишечника.
VI. Діатези: ексудативно-катаральний; алергічний; лімфатико-гіпопластичний; нейроартритичний.
VII. Наявність у дитини хронічних захворювань: системи травлення; системи сечовиділення; серцево-судинної системи; ЛОР-
108
Методи обстеження при стоматологічних захворюваннях у дітей
органів, бронхів і легенів; шкіри; алергічних захворювань; автоімунних хвороб; ендокринопатій і захворювань ендокринної системи; пухлин.
VIII. Перенесені травми і оперативні втручання.
IX. Виявлення патологічних станів: стійка втрата маси тіла нез'я-сованого генезу; лімфаденопатія; часті ГРВІ; тривалий перебіг інфекційних захворювань; гноячкові процеси; діареї. Існують дані лабораторного обстеження дитини, які можуть вказувати на виникнення імунодефіциту (В. Є. Казмірчук, 1996):лімфо-цитопенія менше ніж 1,0х10 /л; уповільнена ШОЕ на тлі бактеріальних захворювань; гіпоглобулінемія; важка гемолітична або апластична анемія.
У клінічній практиці виділяють критичні періоди становлення імунної системи у дітей (Д. В. Стефані, Ю.І.Вельтіщев, 1996):
1. Період новонародженості:
— низька резистентність до умовно-патогенної, піогенної, гемолітичної флори;
— схильність до генералізації гнійно-запальних процесів, до септичних станів.
2. Вік від 3 до 6 міс:
— виражена гіпоімуноглобулінемія;
— первинний характер імунної відповіді;
— вакцинація не дає захисного імунного ефекту і тільки ревакцинація формує вторинну імунну відповідь.
3. Другий рік життя:
— підвищення частоти захворювань унаслідок розширення контактів;
— транзиторна декомпенсація незрілих імунних механізмів і маніфестація аномалій імунітету;
4. Вік від 4 до 6 років:
— завершення періоду формування набутого імунітету;
— хронізація і рецидивування захворювань верхніх дихальних шляхів унаслідок недостатності місцевого імунітету;
5. Період статевого дозрівання:
— підвищена чутливість до мікобактерій туберкульозу;
— зростання частоти автоімунних і лімфопроліферативних захворювань;
стихання атонічних хвороб.
109
Методи імунодіагностики, що нині існують, можна розподілити на 2 фупи (К. Ф. Чернушенко, 1997).
Перша група — такі, що виявляють стан системного імунітету. До них належать кількість лімфоцитів периферичної крові; кількісні і функціональні показники Т-лімфоцитів; кількісні і функціональні показники В-лімфоцитів; К-1 NK-клітини; стан фагоцитуючих клітин (моноцити, нейтрофілоцити); неспецифічні фактори (комплемент, лізоцим, С-протеїн та ін.); показники специфічного імунної відповіді:
клінічні тести, що виявляють ступінь сенсибілізації Т-лімфоцитів;
рівень специфічних антитіл по відношенню до антигену, який відповідає за етіологію захворювання; показники автоімунізації: клітинні тести, які виявляють ступінь сенсибілізації до тканинних антигенів;
рівень автоантитіл, що відповідають локалізації патологічного процесу тощо.
Друга група — показники місцевого імунітету, серед яких слід виділити стан клітинної ланки: кількість клітин секрету чи змиву зі слизових оболонок, фагоцитарну активність макрофагів і нейтрофі-лоцитів секрету, рівні вмісту ферментів, гуморальні фактори — секреторний IgA, лізоцим, бактерицидність.
Показники системного імунітету визначають в умовах імунологічної лабораторії згідно з методиками, описаними в спеціальних посібниках (В. Г. Передерій і співавт., 1995). Для діагностування розладів імунітету у дітей показники хворого порівнюють з аналогічними показниками здорових дітей (табл.17).
Ураховуючи функціональні особливості імунної системи у дітей (генетично детермінований ступінь зрілості, лабільність і великий
Таблиця 17. Показники імунної системи у дітей різних вікових груп (П. С. Мощич, 1994)
Вік,міс, роки |
Т-лімфоцити |
В-лімфоцити |
Імуноглобуліни, г/л |
||||
Ю'/л |
% |
Ю'/л |
% |
igG |
!gA |
IgM |
|
До 4 міс |
2,9-3,8 |
48-53 |
0,5-1,1 |
20-25 |
8,0-8,5 |
О,- 0,08 |
0-0,01 |
Від 4 міс до 1 року |
2,5-2,7 |
55-60 |
0,4-0,6 |
18-23 |
4,0-6,5 |
0,5-0,7 |
0,6 - 0,9 |
|
|
|
|||||
2-7 років |
1,9-2,1 |
60-65 |
0,3 - 0,5 |
17-20 |
7,5-9,0 |
0,8-1,2 |
0,8-1,1 |
8-14 років |
1,5-1,8 |
65-70 |
0,3-0,4 |
18-25 |
8,5-10.5 |
0,9-1,5 |
0,9-1,3 |
110
Методи обстеження при стоматологічних захворюваннях у дітей
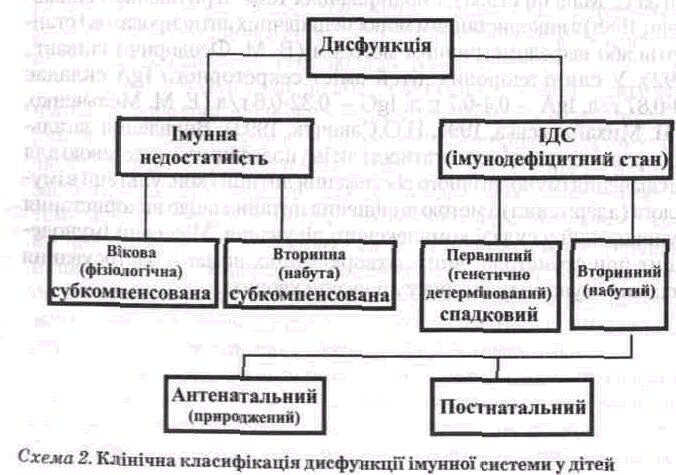
розмах індивідуальних показників, чутливість, виснажливість) дисфункцію на етапі дозрівання необхідно клінічно трактувати з урахуванням двох рівнів її порушення (В. Є. Казмірчук, 1996; схема. 2).
Імунна недостатність — це транзиторне порушенім кількісних або функціональних параметрів імунної системи, що може проявлятися клінічними симптомами, які складають картину зниженої опірності організму. Перший ступінь імунної недостатності характеризується зниженням окремих показників системи імунітету на 50% і більше, другий — на 75% і більше.
Імунодефіцитний стан — це стійкий дефіцит (первинного або вторинного характеру) одного або декількох параметрів (механізмів імунної відповіді), які проявляються в достатньо чітких клінічних симптомах і синдромах.
Характер порушень функції імунітету може бути: функціональним — зворотни.м (віковий або фізіологічний, вторинний або метаболічний) і морфологічним — незворотним (первинний — спадковий; набутий).
У дітей найактуальнішими для реалізації стоматологічних зах-
111
ворювань є показники місцевого імунітету. Стан клітинної ланки місцевого імунітету характеризують на підставі цитологічних досліджень з наступним визначенням індексів співвідношення клітин слизової оболонки ротової порожнини. Індекс співвідношення нейтро-фільних лейкоцитів (ІСНЛ) визначається шляхом підрахунку не-змінених (V нн), фагоцитуючих (V нф) і зруйнованих (V нз) нейтро-і+іілт^них лейкоцитів v питогпамі:
![]()
У здорових дітей цей індекс коливається в межах 9,0-5,9. При гострих запальних процесах показники індексу знижуються. Індекс співвідношення епітеліальних клітин і лейкоцитів (ІСЕЛ) визначається як співвідношення загальної кількості епітеліальних (Ve) клітин у цитограмі і лейкоцитів (Ул):
![]()
У здорових дітей цей індекс коливається в межах o,a-l^,l. ііри запальних процесах він знижується у 2-20 разів.
Найінформативнішим показником місцевого імунітету у дітей є вміст у слині імуноглобулінів, особливо секреторного IgA. Найчастіше він визначається методом радіальної імунодифузіі в агаровому гелі за С. Мапсіпі (1965) в модифікаціях К.Ф.Чернушенко і співавторів (1988) з використанням моноспецифічних антисироваток t стандартів або нефелометричним методом (В. М. Феодорич і співавт., 1992). У слині здорових дітей вміст секреторного IgA складає 3,9-0,87 г/л, IgA - 0,4-0,7 г/л, IgG - 0,32-0,6 г/л (Е. М. Мельченко, В. П. Михайловська, 1991, Н.О.Савичук, 1993). Виявлення загальних проявів імунної недостатності чи імунодефіциту є підставою для призначення імунологічного обстеження дитини і консультації в імунолога (алерголога) з метою вирішення питання щодо використання імунокорекціі у складі комплексного лікування. Місцевий імунодефіцит при стоматологічних захворюваннях вимагає застосування місцевих імуномодуляторів у лікуванні хворих.
