
- •Відповіді до екзамену з дисципліни «Фізика»
- •Обертальний рух твердого тіла.
- •Робота, енергія, потужність, імпульс. Закони збереження імпульсу та енергії.
- •Явища переносу. Значення коефієнта дифузії. Явища переносу. Значення коефієнта в’язкості. Явища переносу. Значення коефієнту теплопровідності.
- •Поняття ентропії та вільної енергії. Зміна ентропії в замкнутих системах (Зміна ентропії в циклі Карно).
- •Перший закон термодинаміки та його застосування до процесів у газах.
- •Характеристика кристалічного стану речовини. Симетрія кристалів. Дефекти в кристалах.
- •Статистичний і термодинамічний методи дослідження.
- •Теплова машина та її ккд.
- •Другий закон термодинаміки та його статистичний зміст.
- •Поняття електричного заряду. Закон Кулона.
- •Електрична індукція. Теорема Гауса.
- •Поняття електричного струму. Закони Ома та Кігхгофа. Електричний опір та його фізична суть.
- •Електрична ємність. Класифікація конденсаторів.
- •Електричне поле в діелектрику. Поляризація діелектриків.
- •Енергія електричного поля. Робота та енергія електричного струму.
- •Електричний струм в металах. Термоелектричні явища.
- •Електричний струм в електролітах. Електрична дисоціація. Закон електролізу Фарадея. Практичне застосування електролізу.
- •Електричний струм в газах. Іонізація газів. Самостійний і несамостійний розряди. Види розрядів у газах, їх практичне використання.
- •Діод. Транзистор. Фізичні основи роботи еом.
- •Електричний струм у напівпровідниках. Власна провідність напівпровідників. Домішкова провідність напівпровідників.
- •Утворення електронно-діркового переходу. Напівпровідникові прилади.
- •Енергія магнітного поля. Магнітне поле. Магнітна проникність. Магнітна стала. Характеристики магнітного поля. Закон Біо-Савара-Лапласа.
- •Взаємодія паралельних струмів. Закон Ампера. Індукція магнітного поля. Магнітний потік. Одиниці їх вимірювання. Магнітне поле прямого та кругового струмів та соленоїда.
- •Дія магнітного поля на провідник із струмом. Сила Ампера.
- •Електромагнітна індукція. Досліди Фарадея. Закон електромагнітної індукції. Правило Ленца. Індуктивність. Самоіндукція.
- •Генератор змінного струму, його будова, принцип дії. Миттєве, амплітудне та діюче значення е. Р.С., напруги та сили змінного струму.
- •Трансформатор, його будова, принцип дії. Використання трансформаторів для передачі електроенергії.
- •Механічні та електромагнітні коливання. Диференціальне рівняння коливального руху. Гармонічні коливання.
- •Вільні коливання. Затухаючі коливання. Дикремент затухання. Вимушені коливання. Явища резонансу та биття.
- •Генератор незатухаючих коливань. Складання коливання. Фігури Ліссажу.
- •Механічні хвилі та їх характеристики. Природа звуку. Характеристики звуку. Ультразвук та його застосування.
- •Історичний огляд вчення про світло. Електромагнітна природа світла.
- •Закони прямолінійного поширення світла. Оптичні прилади. Оптичні властивості ока.
- •2)При відбиванні світла кут падіння світлового променя дорівнює кутові його відбивання
- •Дисперсія світла. Випромінювання та поглинання світла.
- •Інтерференція світла. Способи здійснення інтерференції світла. Інтерференція світла при відбиванні від прозорих пластинок і плівок.
- •Поляризація світла. Поляризація світла при відбивання та заломлення. Закон Брюстера. Подвійне променезаломлення. Обертання площини поляризації. Властивості рідких кристалів та їх застосування.
- •Загальна характеристика теплового випромінювання. Величини, що характеризують властивості теплового випромінювання.
- •Закони випромінювання абсолютно чорного тіла.(Стефана-Больцмана, Віна). Розподіл енергії в спектрі випромінювання абсолютно чорного тіла. Формула Планка.
- •Фотоелектричний ефект. Дослідження Столєтова. Закони фотоефекту.
- •Внутрішній фотоефект. Фотоелементи та їх застосування в техніці. Фотони. Ефект Компотна.
- •Одержання рентгенівського проміння. Його основні властивості. Спектри рентгенівського випромінювання, їх особливості.
- •Ядерна модель атома. Постулати Бора. Правило квантування електронних орбіт.
- •Поняття про квантову механіку. Квантові числа. Принцип Паулі. Розподіл електронів по енергетичних рівнях. Квантові числа. Магнітний момент. Спін електрона.
- •Люмінесценція. Оптичні квантові генератори та їх застосування.
- •Структура ядер. Нуклони. Вплив кулонівських і ядерних сил на стабільність ядер. Заряд і маса ядра. Ізотопи.
- •Природна та штучна радіоактивність. Закон радіоактивного розпаду.
- •Ядерні реакції ділення і синтезу. Дефект мас. Енергія зв’язку нуклонів.
- •Елементарні частинки. Поняття елементарної частинки. Типи взаємодій частинок. Частинки і античастинки та їх класифікація. Поняття кварків.
Ядерна модель атома. Постулати Бора. Правило квантування електронних орбіт.
Узагальнивши результати дослідів, Резерфорд запропонував ядерну (планетарну) модель будови атома, в якій атом має вигляд мініатюрної Сонячної системи. За цією моделлю, весь позитивний заряд і майже вся маса атома (99,4%) зосереджені в атомному ядрі. Розмір ядра (~ 10-15 м) дуже малий порівняно з розміром атома (~ 10-10 м). Навколо ядра по замкнених еліптичних орбітах, які в першому наближені можна вважати коловими, рухаються електрони, утворюючи електронну оболонку атома. Заряд ядра дорівнює сумарному заряду електронів.
Проте запропонована Резерфордом модель будови атома не пояснила спектральних закономірностей і навіть суперечила законам класичної механіки й електродинаміки.
Справді, рух по орбіті, як і всякий криволінійний рух є рухом з прискоренням. За законами класичної електродинаміки, криволінійний рух повинен супроводжуватись випромінюванням світла відповідної частоти. Отже, в процесі руху електрона навколо ядра атом повинен безперервно випромінювати енергію. Але зменшення енергії призводить до зменшення радіуса орбіти електрона - електрон повинен рухатися по спіралі, наближаючись до ядра. А оскільки швидкість руху електрона не змінюється, то повинна збільшуватись і колова частота його обертання, повинна неперервно зростати частота випромінювання, тобто спектр випромінювання повинен бути суцільним. Неперервно наближаючись до ядра, електрон через малий час повинен упасти на ядро, тобто в моделі Резерфорда атом - нестійка система.
Насправді атоми - дуже стійкі системи і мають лінійчаті, а не суцільні спектри випромінювання.В основі борівської теорії атома лежать два основних положення - постулати:
1.Електрони можуть рухатися в атомі по певних орбітах, перебуваючи на яких вони, незважаючи на наявність у них прискорення, не випромінюють.
ці орбіти відповідають стаціонарним станам електронів в атомі визначаються умовою
2.Атом випромінює або поглинає квант електромагнітної енергії при переході електрона з одного стаціонарного стану в інший.
Енергія кванта дорівнює різниці енергій стаціонарних станів електрона до (Ек) і після (Еп) переходу:
Випромінювання відбувається, коли атом переходить із стану з більшою енергією в стан з меншою енергією. Поглинання атомом енергії супроводжується переходом його із стану з меншою енергією в стан з більшою енергією
Отже, на основі теорії Бора можна пояснити наявність лінійчастих спектрів, які утворюються у атома водню при переході з одного стаціонарного стану в інший
Основні властивості атомних ядер. Відкриття нейтрона і позитрона
Згідно з рівнянням Ейнштейна
Е = тс2, енергія зв'язку нуклонів у ядрі дорівнює
![]()
де тp , тn , тя — відповідно маси протона, нейтрона і ядра. Часто замість маси ядра користуються масою атома (т), тоді вираз набуває вигляду:
![]()
де mн — маса атома Гідрогену.
Енергія зв'язку нуклонів у ядрі в мільйони разів.перевищує енергію зв'язку атомів у молекулі, тому при хімічних перевореннях речовин атомні ядра не змінюються.
Величина
Am = [Zmp + (A - Z)m] - тя називається дефектом маси ядра. На цю величину зменшується маса всіхнуклонів при утворенні з них атомного ядра.
Часто
замість енергії зв'язку Е використовують
питому енергію зв'язку ![]() —
енергію зв'язку, віднесену до одного
нуклона. Ця фізична величина дорівнює
тій роботі, яку потрібно зробити для
видалення нуклона з ядра без надання
йому кінетичної енергії. Чим більшим є
значення
,
тим стійкішим є ядро
—
енергію зв'язку, віднесену до одного
нуклона. Ця фізична величина дорівнює
тій роботі, яку потрібно зробити для
видалення нуклона з ядра без надання
йому кінетичної енергії. Чим більшим є
значення
,
тим стійкішим є ядро ![]() .
Найбільш стійкими є магічні ядра, у яких
магічними є і число протонів, і число
нейтронів. Вельми стійкими є ядра
середньої частини таблиці Менделєєва.
Важкі (А > 60) і легкі (А > 12) ядра менш
стійкі. Це означає, що енергетично
вигідними є такі процеси:
.
Найбільш стійкими є магічні ядра, у яких
магічними є і число протонів, і число
нейтронів. Вельми стійкими є ядра
середньої частини таблиці Менделєєва.
Важкі (А > 60) і легкі (А > 12) ядра менш
стійкі. Це означає, що енергетично
вигідними є такі процеси:
1) поділ важких ядер на легші;
2) злиття легких ядер у важчі.
Обидва процеси протікають із виділенням величезної кількості енергії, що дозволяє практично використовувати ці реакції (термоядерні, реакції поділу).
Хвильові властивості речовини. Хвилі де Бройля. Досліди Девісона і Джермера.
Ідея приписати хвильові властивості електрону належить французькому фізику Луї де Бройлю. Проводячи аналогію між квантом, який має енергію і , та імпульсом р , де Бройль припустив, що
рух електрона або будь-якої іншої частинки, яка має масу спокою, пов'язаний із хвильовим процесом.
Цьому
процесу відповідає хвиля (хвиля де
Бройля),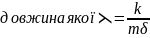 Ґрунтуючись на гіпотезі де Бройля, можна
пояснити перший постулат Бора. Підставивши
значення визначене з формули
1,
дістанемо
Ґрунтуючись на гіпотезі де Бройля, можна
пояснити перший постулат Бора. Підставивши
значення визначене з формули
1,
дістанемо
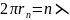
Це співвідношення показує, що з точки зору гіпотези де Бройля стаціонарними є лише ті орбіти, на яких вкладається ціле число хвиль де Бройля. Оскільки частинки речовини мають хвильові властивості, то можна спостерігати їх інтерференцію і дифракцію. Саме з цього боку гіпотеза де Бройля і дістала експериментальне підтвердження в ряді дослідів, під час яких встановлено дифракцію електронів, протонів, нейтронів, атомів
У 1927 р. К. Девіссон і Л. Джермер вивчали розсіяння електронів намонокристалі нікелю. Досліди показали, що при заданому куті падіння електрони відбиваються від поверхні кристала під різними кутами, причому в одних напрямах виникали максимуми числа відбитих електронів, в інших - мінімуми, тобто спостерігалась дифракційна картина. Досліди Девіссона і Джермера встановили, що електрони дифрагували як хвилі, довжини цих хвиль точно збігалися з довжинами хвиль де Бройля.
Хвильові властивості характерні не тільки для пучка рухомих частинок, а й для окремої рухомої частинки. За допомогою дослідів В. Фабрикант, Г. Біберман і П. Сушкін виявили явище дифракції одиночних електронів. Обстрілюючи металеву плівку окремими електронами, також спостерігали дифракційну картину, як і тоді, коли проходив пучок електронів. Отже, електрони, як і фотони, мають подвійну корпускулярно- хвильову природу. Корпускулярні і хвильові характеристики зв'язані між собою квантом дії - сталою Планка
