
- •Синдром поликистозных яичников этиология, патогенез, диагностика и лечение
- •Введение 3
- •Актуальность проблемы 4
- •Приложения 41
- •Литература
- •Введение
- •Учреждение-разработчик:
- •Составители:
- •Актуальность проблемы
- •Кистозная атрезия фолликулов
- •Спя и метаболический синдром
- •Генетика спя
- •Внешний вид больной со стромальным текоматозом яичников
- •Homeostasis Model Assessment (нома-баллов):
- •Основные принципы лечения спя
- •При ир и ги как с избыточной массой тела, так и с нормальным весом
- •Литература
Андрогенная
функция яичников оценивается по уровню
Т в крови. Уровень общего Т при СПЯ чаще
находится на верхней границе нормы (в
норме - от 0,7 до 2,7 нмоль/л). Содержание
СССГ при СПЯ как правило снижено (< 30
нмоль/л) и косвенно указывает на повышение
уровня свободного, биологически
активного Т, свободно трансформирующегося
в активную форму - 5а-дигидротестостерон.
Содержание
эстрадиола в плазме находится в пределах
нормы или несколько повышено. Прогестерон
при отсутствии желтого тела, естественно,
соответствует ранней фолликулярной
фазе.
Уровень
ДГЭА-С и 17-0Н-прогестерона нормальный
или немного повышенный. Более значительное
повышение обязывает проводить
дифференциальную диагностику с
надпочечниковой гиперандрогенией.
Уровень
экскреции с мочой суммарных 17-КС при
СПЯ колеблется в широких пределах и
мало информативен. Определение фракций
17-КС (ДГА, 11-окисленных кетостероидов,
андростерона, этиохоланолона) также
не обеспечивает выявление локализации
источника гиперандрогении.
При
исследовании углеводного обмена почти
у 40% больных с СПЯ выявляется ИР и ГИ,
причем как при избыточной массе тела,
так и при нормальном весе. Нарушенная
толерантность к глюкозе обнаруживается
примерно у 5% больных.
Наиболее
распространена оценка состояния
углеводного обмена и инсулинорезистентности
по следеющим критериям.
Индекс
Саго: уровень
глюкозы плазмы натощак (ммоль/л) /
уровень ИРИ плазмы натощак (мкЕд/мл);
показатели < 0,33 указывают на наличие
инсулино-резистентности.
уровень
ИРИ плазмы натощак (мкЕд/мл) х уровень
глюкозы плазмы натощак (ммоль/л) / 22,5.
Между
двумя этими формулами выявлена высокая
степень обратной корреляционной
зависимости (г = -0,86).
ИРИ
> 13 мкЕд/л натощак уже может указывать
на риск развития инсулинорезистентности.
Стандартный
пероральный глюкозотолерантный тест
с 75 г сухой глюкозы. Об
инсулинорезистентном состоянии
свидетельствует значи-тельное повышение
уровня ИРИ натощак. Постнагрузочные
показатели ИРИ не являются диагностическими
критериями ИР.
Типично
для СПЯ нарушение липидного обмена:
гипертриглице- ридемия, повышение
индекса атерогенности.
Homeostasis Model Assessment (нома-баллов):
■
Критерии
диагноза СПЯ
Наличие
характерного анамнеза.
Состояние
хронической ановуляции, сопровождающееся
нарушением менструальной функции
по типу олиго-опсоменореи или аменореи.
Ультразвуковые
признаки СПЯ.
Умеренное
повышение уровня Т при сниженном уровне
СССГ.
Андрогензависимая
дермопатия.
У
половины больных повышение ИМТ и
висцеральное ожирение.
Наличие
инсулинорезистентности и гиперинсулинемии.
Гипертриглицеридемия,
повышение индекса атерогенности.
Часто
- повышение уровня ЛГ.
Исключение
других причин гиперандрогении.
Симптомы
андрогензависимой дермопатии:
гирсутизм,акне, себорея, алопеция и
другие симптомы гиперандрогении
Симптомы
андрогензависимой дермопатии при СПЯ
напрямую отражают периферические
эффекты избытка андрогенов, характерного
для заболевания. Усиленное оволосение
по мужскому типу у женщин, называемое
гирсутизмом, отражает стимуляцию
андрогенами волосяных фолликулов.
Гирсутизм при СПЯ - индуцированное
андрогенами превращение пушковых
волос в терминальные (пигментированные,
длинные, толстые волосы), ограниченное
зонами аналогичного оволосения у
мужчин. Жесткие, длинные, обычно
пигментированные волосы преимущественно
на верхней губе, подбородке, зоне роста
бакенбардов, вокруг сосков, на груди,
на нижней части живота, в промежности
и на внутренней поверхности бедер (фото
3).
Фото
3
Гирсутизм

Однако
степень гирсутизма при СПЯ не всегда
коррелирует со степенью избытка
андрогенов. Тяжелый гирсутизм может
наблюдаться при незначительном повышении
уровня андрогенов в сыворотке крови,
а значительное повышение показателей
не всегда сопровождается гирсутизмом.
Это несоответствие между уровнем
гормонов и степенью выраженности
гирсутизма отражает разную индивидуальную
чувствительность ткани-мишени к этим
гормонам. Следует также иметь ввиду,
что гирсутизм может быть связан с ранее
существовавшим избытком андрогенов,
и на момент обследования их уровень
оказывается нормальным.
Еще
одно проявление андрогензависимой
дермопатии при СПЯ - жирная себорея,
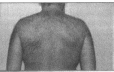
«салотечение». Проявляется усиленной
продукцией кожного сала под влиянием
андрогенов. Себорея проявляется на
лице в области лба и носогубного
треугольника, на передней поверхности
грудной клетки, на спине, особенно в
межлопаточном пространстве и в области
плеч, на волосистой части головы (фото
4).
Фото
4
Жирная
себорея
Жирная
себорея может быть одним из предрасполагающих
фактором развития акне - элементов,
представленных открытыми и закрытыми
комедонами, папулами, пустулами кистами.
Основные
патогенетические факторы возникновения
акне:
нарушения
процессов кератинизации;
дисбаланс
липидов;
возрастание
патогенности Propionbacterium
acnes;
активация
сальных желез на фоне наследственной
предрасположенности;
андрогенная
стимуляция рецепторов сальных желез
(фото
5).
Фото
5
Акне
г
с;
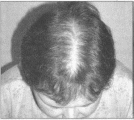
Многие
женщины, страдающие СПЯ, обращаются с
жалобами на выраженное выпадение волос
на голове. Андрогензависимое облысение,
или алопеция, - это инволюция терминальных
волос до коротких тонких волос пушкового
типа, диффузное выпадение волос в стадии
телогена. Зоны преобладающей локализации:
центрально-теменная и/или височные
поверхности головы; нередко узкая
полоска волос сохраняется на лбу.
Установлена генетическая предрасположенность
к данному виду облысения (фото
6).
Фото
6
Алопеция
Весь
комплекс указанных выше симптомов со
стороны кожи называется андрогензависимой
дермопатией.
I
ОО
Патанатомия
Двустороннее
увеличение яичников - наиболее
патогномоничный симптом СПЯ. Белочная
оболочка с перламутровым оттенком,
утолщена и склерозирована, нередко
инъецирована сосудами. Через нее
просвечивают кистозно-измененные
фолликулы диаметром 0,6-0,8 см и более.
Желтые тела, как правило, не обнаруживаются.
Микроскопически
в корковом слое сохраняется нормальное
или несколько уменьшенное количество
примордиальных фолликулов. Характерная
особенность - кистозная атрезия
фолликулов с дегенерацией клеток
гранулезы, их персистенция. Наблюдается
гиперплазия и гипертрофия клеток
внутренней теки, а также межуточной
ткани коркового слоя яичников. Желтые
и белые тела отсутствуют или встречаются
редко. Белочная оболочка утолщена и
склерозирована.
Дифференциальный
диагноз
СПЯ
необходимо дифференцировать с другими
формами гиперандрогении, прежде всего
с поликистозом яичников на фоне
гиперандрогении надпочечникового
генеза и заболеваний гипоталамо-
гипофизарной системы, а также с
андрогенпродуцирующими опухолями
яичников и надпочечников.
Поликистоз
яичников на фоне заболеваний гипоталамо-
гипофизарной системы:
-
гипоталамо-гипофизарный синдром с
ожирением (включая опухоли ее различных
отделов);
-гиперпролактинемия
(функциональная и пролактиномы);
-акромегалия;
-болезнь
Иценко-Кушинга;
-гипотиреоз
(вторичный).
Поликистоз
яичников на фоне гиперандрогении
надпочечникового генеза:
-врожденная
дисфункция коры надпочечников
(классическая и неклассическая формы);
-синдром
Иценко-Кушинга;
-андрогенпродуцирующие
опухоли надпочечников (андростеромы);
-первичный
рак коры надпочечников.
АКТГ-эктопированный
синдром.
Андрогенпродуцирующие
опухоли яичников.
Первичный
гипотиреоз.
Заболевания
печени с нарушением синтеза белков
(СССГ).
«Идиопатический»
и конституционально-наследственный
гирсутизм.
Ятрогенный
гирсутизм (в результате приема
анаболических стероидов, даназола,
некоторых гестагенов, андрогенов,
глюкокортикоидов и др.).
При
поликистозе яичников на фоне
гипоталамо-гипофизарного синдрома с
ожирением нарушения
менструальной и овуляторной функции
наступают после появления ожирения,
которое развивается по «нижнему» типу,
при котором нарушения углеводного
обмена развиваются позднее. На первый
план выступают симптомы повышения
внутри-черепного давления с головной
болью, вегетативные нарушения -
лабильность артериального давления,
бессонница и др. Данные УЗИ органов
малого таза выявляют незначительное
увеличение размеров яичников,
множественные фолликулярные кисточки
диаметром 0,4-0,б см, склероз белочной
оболочки выражен не так резко. При
исследовании гонадотропной функции
нет резкого повышения ЛГ. Уровень Т,
как правило, не повышен.
При
гиперпролактинемии типичные
симптомы - вторичная аменорея и
галакторея на фоне гипоплазии матки.
Андрогензависимая дермопатия выражена
слабо. Увеличение яичников возможно,
но наблюдается редко. Уровни ЛГ и ФСГ,
как правило, несколько снижены. Базальный
уровень пролактина повышен, при
пролактиномах значительно и снижена
его реакция на стимуляцию метоклопрамидом
и рифатироином. Уровень Т, как правило,
не повышен, в то время как уровень ДГЭА-С
умеренно увеличен. При КТ или МР-Т головы
при опухолевой форме гиперпролактинемии
обнаруживается микро- или макроаденома
гипофиза.
В
дебюте акромегалии может
развиваться симптоматика СПЯ: ановуляция,
опсоменорея, гиперандрогения,
андрогензависимая дермопатия, увеличение
размеров яичников и кистозные изменения
в них. Довольно быстро присоединяются
специфические симптомы акромегалии.
Достоверным диагностическим критерием
является определение уровня СТГ.
При
болезни Иценко-Кушинга первыми
проявлениями заболевания также могут
быть ановуляция, опсоменорея или
аменорея, гирсутизм и акне, увеличение
размеров яичников и их кистозные
изменения, однако достаточно быстро
начинают преобладать симптомы
гиперкортизолемии. Повышается суточная
экскреция с мочой свободного кортизола,
нарушается суточный ритм секреции
кортизола в крови.
I
5/,
При
гипотиреозе за
счет снижения синтеза стимулируемого
тироксином СССГ увеличивается уровень
свободного Т, который и вызывает сходную
с СПЯ симптоматику.
При
заболеваниях надпочечников, при
которых имеется повышение уровня
надпочечниковых андрогенов (ДГЭА-С),
может развиваться вторичный поликистоз
яичников. Наиболее часто причиной этого
является неклассическая форма врожденной
дисфункции коры надпочечников (ВДКН),
связанная с дефицитом 21-гидроксилазы
в результате точечных мутаций гена
CYB21B.
Встречается с частотой 1 на 12000 - 1 на
60000 новорожденных.
При
неклассической форме ВДКН, «мягких»
формах 21-гидроксилазной недостаточности
клиническая картина заболевания
зачастую ограничивается легкими формами
гирсутизма и угревой сыпи, незначительной
опсоменореей или гиполютеиновой
дисфункцией яичников, бесплодием или
привычным выкидышем. Нередко имеются
признаки поликистозных яичников.
Вирилизации наружных гениталий обычно
не наблюдается, как не наблюдается и
клинических проявлений недостаточности
глюкокортикоидов и минералокортикоидов,
то есть отсутствуют симптомы
гипокортицизма. При УЗ исследовании
надпочечников или при МР-Т гиперплазия
надпочечников не выявляется.
Именно
при этой форме ВДКН дифференциальный
диагноз с СПЯ представляет наибольшие
трудности. Незначительное повышение
основных андрогенов возможно в обоих
случаях. Повышение уровня надпочечниковых
андрогенов - ДГЭА-С и 17-ОН-прогестерона
возможно и при СПЯ, если вспомнить, что
в синтезе андрогенов как в надпочечнике,
так и в яичнике ключевую роль играет
цитохром Р450с17а (17а-гидро- ксилаза и
17,20-лиаза), активность которого повышается
при гиперинсулинемии, выявляемой почти
у половины больных с СПЯ. Ультразвуковая
картина яичников при СПЯ и вторичном
поликистозе яичников при ВДКН во многом
сходна. Наиболее достоверным
диагностическим критерием является
проба с АКТГ (синактен депо 1мл/1мг) с
определением 17-ОН-про-гестерона,
кортизола, ДГЭА-С и тестостерона исходно
и через 24 часа.
Многократное
повышение 17-ОН-прогестерона одновременно
с умеренным повышением Т и ДГЭА-С
свидетельствует в пользу ВДКН. Широко
применяемая на практике проба с
дексаметазоном с определением уровня
экскреции с мочой суммарных 17-КС
абсолютно не информативна в диагностике
этого заболевания.
В
настоящее время широко используются
методы молекулярной генетики, позволяющие
выявить диагностически значимые мутации
гена CYP21B
и достоверно подтвердить диагноз ВДКН.
Опухолевый
генез гиперандрогении как
надпочечникового, так и яичникового
генеза проявляется быстрым началом и
бурным прогрессированием симптомов
вирильного синдрома и в этом плане
диагностических трудностей не
представляет. Это касается и синдрома
Иценко-Кушинга с учетом преимущественной
секреции кортизола. Однако топическая
диагностика опухолевой гиперандрогении
весьма затруднительна. Сначала
дифференциальная диагностика проводится
между овариальным и надпочечниковым
генезом гиперандрогении: повышение
уровня Т в 5-10 раз, выше 12,0 нмоль/л при
нормальном уровне ДЭА-S
и 17-0Н-Р характерно для овариальных
опухолей, а обратное соотношение
является типичным для надпочечниковых
опухолей. Для опухолевого генеза
гиперандрогении характерно также
снижение уровня гонадотропных гормонов
(ЛГ и ФСГ). Для топической диагностики
применяются УЗИ органов малого таза и
компьютерная или магнитно-резонансная
томография (МРТ) надпочечников
(приложение
IV).
Использование КТ и МРТ в исследовании
органов малого таза малоинформативно.
Андрогенпродуцирующие
опухоли яичников
Андрогенпродуцирующие
(вирилизирующие или маскулинизирующие)
опухоли яичников являются редкой
патологией и встречаются у одной из
30000 гинекологических стационарных
больных или составляют около 5% от всех
опухолей яичников. Опухолевые клетки
являются источником повышенной продукции
мужских половых гормонов - андрогенов
(Т и А). Нередко наблюдается смешанная
продукция андрогенов и эстрогенов (Э2,
Э1).
Патанатомия.
Андрогенпродуцирующие
опухоли происходят из стро- мы полового
тяжа и стероидпродуцирующих клеток.
Морфологические признаки малигнизации
выявляются в 20% случаев, однако практика
показывает, что эти опухоли клинически
протекают без осложнений, метастазы
дают крайне редко, что и определяет
благоприятный прогноз.
Гранулезоклеточная
опухоль -
составляет 1-2% всех опухолей яичников.
Встречается в любом возрасте и чаще
дает клиническую картину гиперэстрогении:
в чадородном периоде и периоде менопаузы
с метроррагией, в детском возрасте
приводит к развитию ложного
!
преждевременного
полового развития по изосексуальному
типу. При вирилизирующем варианте
опухоли обнаруживают текаклеточный и
стромальный компоненты, образованные
либо типичными текальными клетками,
либо фибробластоподобными клетками,
которые, вероятно, и являются
андрогенпродуцирующими. Макроскопически
эти опухоли представляют инкапсулированный
узел от 2-3 до 10-20 см в диаметре. Строение
солидно-кистозное, кистозное или
солидное. Опухолевые клетки мелкие,
формируют структуры типа розеток с
базофильными массами в центре
(колл-экснеровские тельца), ядра
относительно крупные, плотные.
Текома
-
вирилизирующая опухоль, наиболее часто
встречающаяся среди андрогенпродуцирующих
опухолей, в 3-5% с морфологическими
признаками малигнизации. Встречается
в любом возрасте, чаще в период менопаузы.
Отличительная черта - небольшие размеры
опухоли, от 1 до 3 см, иногда двусторонние,
без капсулы, с мелкобугристой поверхностью,
охряно-желтого или бурого цвета. Текома
образована эпителиоидными клетками,
напоминающими клетки theca
interna.
Цитоплазма оксифильная, мелкозернистая,
содержит лютеин и липиды. Гистохимия
выявляет высокую функциональную
активность ферментов, участвующих в
стероидогенезе. Почти в половине случаев
андрогенная продукция сочетается с
гиперэстрогенией.
Андробластома
-
опухоль из клеток полового тяжа (клеток
Сертоли) и стромальных клеток (аналогичных
тестикулярным клеткам Лейдига). Частота
составляет 0,5% от всех опухолей яичников,
в 3-5% бывает двусторонней. Встречается
в любом возрасте. Гистологически
выделяют «чистые» опухоли из клеток
Сертоли или Лейдига и «смешанные»
опухоли Сертоли-Лейдига, а также высоко-
и низкодифференцированные их варианты.
Липидоклеточные
опухоли -
встречается редко (0,1% от всех опухолей
яичников). По классификации ВОЗ в эту
группу включены опухоли, содержащие
большое количество липохромного
пигмента и липидов в клетках, которые
имеют сходное строение с лютеиновыми
клетками, клетками Лейдига и коры
надпочечников. К ним относят лютеомы,
стромальные лютеомы, лютеомы беременности,
опухоли из клеток Лейдига (хилюсных
клеток), из дистопий коркового слоя
надпочечника. Признаки малигнизации
выявляются в 5-20% чаще в опухолях из
дистопий коры надпочечника. Нередко
андрогенная продукция сочетается с
секрецией эстрогенов опухолью, что
клинически может проявляться метроррагий.
Чаще это наблюдается при стромальной
лютеоме, которая обычно бывает
двусторонней.
Симптомы
вирилизации
обнаруживаются у больных с различными
эпителиальными опухолями, муцинозной
цистаденомой, доброкачественной
тератомой, опухолью Бреннера, опухолью
Круккенберга. При морфологическом
исследовании выявляют гиперплазию
стромальной ткани яичника, окружающей
опухоль, а именно текальных и хилюсных
клеток с их лютеинизацией.
Клиническая
картина полностью
определяется уровнем гиперандрогении
и не зависит от морфологического
строения опухоли.
Менструальная
функция нарушается чаще по типу вторичной
аменореи, в случае смешанной продукции
опухолью андрогенов и эстрогенов
возможна и метроррагия. Одновременно
появляются и симптомы вирилизации:
бурно прогрессирующий гирсутизм,
угревая сыпь, жирная себорея, андрогенная
алопеция, снижается тембр голоса
(барифония). Появляется дефеминизация
- исчезновение вторичных половых
признаков: уменьшаются в размерах и
становятся «дряблыми» молочные железы,
уменьшаются жировые отложения на
бедрах, телосложение приближается к
мужскому.
При
гинекологическом осмотре обращает на
себя внимание гипертрофия и вирилизация
клитора, слизистые становятся атрофичными,
с цианотичным оттенком. При смешанной
андроген-эстрогенной секреции возможно
увеличение размеров матки в связи с
развитием миомы. Иногда удается
пальпировать увеличенный яичник
(опухоль). При кольпоцито- логическом
исследование КПИ снижается до 0,
преобладают парабазальные и базальные
клетки влагалищного эпителия. Симптом
«зрачка» отрицательный.
Диагноз.
Ввиду
выраженности клинической картины и
быстрого прогрес-сирования симптомов
вирилизации диагноз андрогенпродуциру-
ющей опухоли не вызывает затруднений,
однако топическая диагностика опухоли
в связи с ее малыми размерами представляет
значительные трудности. Уровень Т крови
значительно повышен (выше 12,0 нмоль/л).
Степень его повышения коррелирует с
выраженностью вирильного синдрома в
целом. При гормональном исследовании
уровень эстрогенов может быть низким,
нормальным или повышенным. Уровень ЛГ
и ФСГ может быть разным, но чаще находится
в пределах нормы. Имеет диагностическое
значение в период менопаузы, когда под
воздействием высокого уровня андрогенов
становится низким (а не высоким, как
I
по
в
менопаузе). Уровень пролактина остается
в пределах нормы или несколько повышен.
При достаточно больших размерах опухоли
она легко определяется при гинекологическом
осмотре, но андрогенсекретирующие
опухоли нередко имеют диаметр от 1 до
3 см. В такой ситуации в 60-70% помогает
УЗИ органов малого таза, однако опухоли
диаметром 1-2 см и без капсулы этим
методом не определяются. Компьютерная
томография и даже МР-томография никаких
преимуществ перед УЗ методом не имеет.
Большие надежды возлагались на
лапароскопическую диагностику, однако
малые размеры опухоли и ее глубокое, в
области ворот яичника, расположение
не подтвердили ожидания.
В
тех случаях, когда топическая диагностика
не привела к результату, проводят
селективную катетеризацию вен яичников
и надпочечников с ретроградной
флебографией и с забором оттекающей
от органов крови с определением в ней
Т, ДЭА-S,
17-гидроксипрогестерона, кортизола.
Критерием для дифференциальной
диагностики источника гиперандрогении
служат не абсолютные показатели уровня
Т, определяемого в каждой пробе крови,
а величина яичниково-периферического
градиентов его концентраций, а также
одно- или двусторонний характер их
увеличения.
Дифференциальный
диагноз. При
андрогенпродуцирующих опухолях яичников
проводится с андрогенпродуцирующими
опухолями надпочечников (андростеромы),
с болезнью (синдромом) Иценко-Кушинга.
Сложен
дифференциальный диагноз между
андрогенпродуцирующими опухолями
яичников и надпочечников, поскольку
их клиническая картина во многом сходна.
Однако при андростеромах при гормональном
исследовании определяется повышение
уровня ДЭА-S,
а не Т. Использование функциональных
проб с ДМ и АКТГ выявляет автоном-ность
его продукции. КТ, МРТ и УЗИ в большинстве
случаев позволяют локализовать опухоль.
В случае отрицательного результата
исследований селективная катетеризация
вен яичников и надпочечников с
определением Т и ДГЭА-С по их градиенту
с парным органом и периферической
кровью с высокой достоверностью
позволяет верифицировать диагноз.
Дифференциальная
диагностика с гиперкортизолемией,
сопровождающейся гиперандрогенией,
не представляет затруднений. При СТЯ,
несмотря на выраженную вирилизацию,
базальный уровень Т достоверно ниже,
чем при опухолях.
Лечение.
Лечение
андрогенпродуцирующих опухолей только
оперативное - удаление опухоли. При
наличии капсулы опухоли возможно
сохранение здоровой овариальной ткани
этого яичника, при этом обязательна
биопсия второго яичника, при отсутствии
капсулы опухоли производится удаление
яичника (аднексэктомия). Такая щадящая
органосохраняющая тактика, по мнению
многих авторов, является профилактикой
эндокринных нарушений, являющихся
фоном для развития рецидивов опухоли.
Исключение составляют больные в
перименопаузе, когда производится
надвлагалищная ампутация тела матки
или экстирпация с придатками. В случае
обнаружения отдаленных метастазов
проводится химиотерапия. После операции
наступает быстрое и стойкое снижение
уровня Т до нормальных величин. Его
уровень после операции может быть
использован как маркер рецидива опухоли.
Практически
у всех больных чадородного периода
после удаления опухоли восстанавливается
менструальная функция, проходит
дефеминизация, резко уменьшается или
исчезает гирсутизм, наблюдается
смягчение голоса. Восстанавливается
фертильность. У пациенток старшего
возраста или при длительно существовавшей
опухоли элементы андрогензависимой
дермопатии могут сохраняться. После
операции больные требуют диспансерного
наблюдения с обязательным контролем
овуляторной функции. В случае нарушения
овуляции проводится ее стимуляция
обычными методами. Восстановление
овуляции, как показателя полноценной
функции яичников, является необходимым
условием профилактики рецидива. Для
устранения сохраняющихся гирсутизма,
алопеции могут применяться антиандрогенные
препараты. Прогноз после удаления
андрогенпродуцирующей опухоли при
отсутствии метастазов - благоприятный.
Андрогенпродуцирующие
опухоли надпочечников
Андростерома
- опухоль коры надпочечника, продуцирующая
андрогены (ДГЭА-С и Т). Встречается
довольно редко, составляет 1-3% всех
опухолей надпочечников. Выявляется во
всех возрастных группах, на чаще
выявляется у женщин до 40 лет.
Андрогенпродуцирующие
опухоли имеют как правило хорошо
развитую соединительнотканную капсулу.
Эти новообразования достигают больших
размеров и массы, до 1000 г. Опухоли
диаметром 5 см и более почти всегда
злокачественны.
Патанатомия.
При
гистологическом исследовании
доброкачественные опухоли содержат
компактные клетки нормальных размеров
с пузыревидными ядрами. В злокачественных
опухолях отмечается ядерный и клеточный
полиморфизм и атипизм с формированием
синцитиальных и альвеолярных структур.
Возможно метастазирование в легкие,
печень и другие органы.
Клиническая
картина. Как
и при андрогенпродуцтрующих опухолях
яичников определяется уровнем
гиперандрогении. Характеризуется
внезапным началом и бурным прогрессированием
симптомов вирилизации: прогрессирующий
гирсутизм, акне, дефеминизация и
маскулинизация фигуры, алопеция, атрофия
молочных желез, барифония. Менструальная
функция прекращается внезапно,
прогестеро- новая проба отрицательна.
Диагноз
и дифференциальный диагноз. Ранняя
диагностика андростером имеет важное
значение, так как половина этих опухолей
имеет злокачественный характер.
При
андростероме уровень ДГЭА-С и Т возрастает
в десятки раз. Резко повышается и
экскреция с мочой суммарных 17-КС.
Экскреция 17-ОКС и уровень кортизола в
крови как правило не изменяются, их
повышение свидетельствует о смешанном
характере опухоли - глюкоандростероме.
Дексаметазоновая проба не приводит к
снижению андрогенов, что свидетельствует
об автономности их продукции опухолью.
Дифференциальный
диагноз
проводится с андрогенпродуцирую- щими
опухолями яичников, СТЯ, болезнью и
синдромом Иценко-Кушинга.
Решающее
значение при постановке диагноза и в
топической диагностике имеют КТ и МРТ,
дополнительно может быть использована
селективная катетеризация вен яичников
и надпочечников с ретроградной
флебографией. УЗИ помогает выяснить
топографические взаимоотношения
опухоли с почкой, аортой, нижней полой
веной, селезенкой и печенью, что
необходимо для выбора оперативной
тактики.
Лечение
андростером только оперативное -
удаление пораженного опухолью
надпочечника. При отсутствии метастазов
симптомы вирилизации быстро
подвергаются регрессу, восстанавливается
овуляторная функция яичников и
фертильность. Прогноз благоприятный.
В запущенных случаях с неоперабельными
опухолями или отдаленными метастазами
лечение симптоматическое и прогноз
неблагоприятный.
