- •Синдром поликистозных яичников этиология, патогенез, диагностика и лечение
- •Введение 3
- •Актуальность проблемы 4
- •Приложения 41
- •Литература
- •Введение
- •Учреждение-разработчик:
- •Составители:
- •Актуальность проблемы
- •Кистозная атрезия фолликулов
- •Спя и метаболический синдром
- •Генетика спя
- •Внешний вид больной со стромальным текоматозом яичников
- •Homeostasis Model Assessment (нома-баллов):
- •Основные принципы лечения спя
- •При ир и ги как с избыточной массой тела, так и с нормальным весом
- •Литература
В
дальнейших исследованиях (Д. Барген,
1981) было обнаружено, что у женщин с СПЯ
и гиперандрогенией отмечалась базальная
и глюкозостимулированная гиперинсулинемия
(ГИ) по сравнению с контрольной группой
женщин одинакового веса, это предполагало
наличие инсулинорезистентности (ИР).
ГИ и ИР выявляли при СПЯ как при
избыточной, так и при нормальной массе
тела. Была выявлена прямая зависимость
между уровнями инсулина и андрогенов
и сделано предположение: причиной
гиперандрогении может быть ГИ, а не
наоборот, поскольку:
ГИ
сохраняется и после удаления поликистозных
яичников;
ИР
и ГИ сохраняются после длительного
применения рилизинг гормона (Гн-РГ)
после подавления уровня андрогенов;
у
девочек в препубертате с acanthosis
nigricans
наблюдается ГИ, а признаки гиперандрогении
проявляются значительно позже;Кистозная атрезия фолликулов
у
женщин с точечными мутациями в гене
инсулинового рецептора, являющегося
причиной ГИ, выявляют СПЯ;
у
мужчин уровень андрогенов в 10-30 раз
выше, чем у женщин, но у них нет ИР.
На
причинную роль ГИ в развитии гиперандрогении
указывают:
обнаружение
рецепторов к инсулину в овариальной
ткани;
данные
о супрессии продукции инсулина
[3-клетками у женщин
с
СПЯ с помощью диазоксида с одновременным
снижением уровня тестостерона;
данные
о длительной терапии инсулином больной
с СПЯ и высокой ИР, результатом которой
стало значительное повышение уровня
тестостерона и двукратное увеличение
объема яичников.
Большинство
исследователей рассматривают сегодня
СПЯ как эндокринное заболевание, тесно
связанное с ИР и компенсаторной ГИ.
ИР
- ключевое звено в патофизиологии СПЯ
и усиливает симптомы и признаки
заболевания, а также ассоциируется с
рядом метаболических нарушений и
сердечно-сосудистыми заболеваниями.
Инсулин, связываясь с рецептором,
инициирует запуск ряда процессов, в
том числе, аутофосфорилирование тирозина
инсулинового рецептора (иР), что
активирует сам рецептор и последующее
фосфорилирование промежуточных звеньев
инсулиновой внутриклеточной сигнальной
системы (например, субстрат инсулинового
рецептора-1 «IRS-1»),
что в конечном итоге приводит к
мобилизации транспортеров глюкозы и
захвату глюкозы клеткой.
При
СПЯ ИР может быть обусловлена нарушением
аутофосфорилиро- вания (3-субъединиц
иР, цитоплазматическая часть которых
обладает тирозинкиназной активностью.
При этом повышается инсулиннезависи-
мое фосфорилирование остатков серина
(PCOS-ser)
р-субъединиц иР и снижается инсулинзависимое
фосфорилирование остатков тирозина с
подавлением активности тирозинкиназы
(вторичный передатчик сигнала,
определяющий чувствительность инсулина
к одноименным рецепторам). Данный дефект
характерен только для СПЯ-зависимой
ИР, при других инсулинорезистентных
состояниях (ожирение, ИНСД, Leprechaunism)
эти изменения не выявляются.
Нельзя
исключить, что при PCOS-ser
существует некий серинфосфорили- рующий
фактор. Так, например, выделяют ингибитор
серин/треонинфосфа- тазы, который по
всей видимости и нарушает фосфорилирование
иР при PCOS-ser.
Данное соединение схоже с недавно
выделенным мембранным
I
о
гликопротеидом
РС-1 (ингибитор тирозинкиназы иР), но
последний не увеличивает инсулиннезависимое
фосфорилирование серина иР.
Подобными
свойствами обладает и фактор некроза
опухоли - альфа (ФНО-а). Фосфорилирование
остатков серина IRS-1
(один из вторичных передатчиков сигнала
иР) под влиянием ФНО-а влечет за собой
подавление тирозинкиназной активности
иР.
В
50% случаев указанных нарушений при СПЯ
обнаружено не было (PCOS-nl).
Несмотря на то, что женщины с PCOS-nl
и PCOS-ser
имели схожий фенотип и степень ИР,
фосфорилирование иР фибробластов и
миоцитов, полученных от женщин с PCOS-nl
не отличалось от такового контрольных
образцов. В связи с чем авторы предположили,
что ИР при PCOS-nl
первично определяется нарушением
фосфорилирования субстрата инсулинового
рецептора-1 (IRS-1)
или снижением активности
фосфатидилинозитол-3-киназы (PI3-K).
На
первый взгляд может показаться
парадоксальным, что инсулин стимулирует
продукцию андрогенов в яичниках, в то
время как организм резистентен к
действию инсулина. Существует несколько
объяснений тому, как организм, резистентный
к эффектам инсулина на транспорт
глюкозы, может оставаться полностью
чувствительным к стимуляции инсулином
биосинтеза андрогенов в яичнике.
Во-первых, инсулин может перекрестно
реагировать с рецепторами к ИФР-1 в
яичниках. Во-вторых, инсулин может
действовать косвенно путем снижения
интрафолликулярного уровня протеина,
связывающего ИФР-1, при этом возрастает
содержание интрафолликулярной
концентрации свободного ИФР-1, который
индуцирует рецепторы ЛГ в
андрогенпродуцирующих клетках яичника.
Можно
также предположить, что для стимуляции
яичниковой продукции андрогенов и
стимуляции транспорта глюкозы существуют
различные внутриклеточные сигнальные
системы. Исследования J.E.
Nestler
(1991) и G.
Romero
(1993) позволяют предположить, что
инозитолфосфогликан - «вторичный
мессенджер» внутриклеточной сигнальной
системы стимуляции стероидогенеза в
этих тканях. Инозитолфосфогликан -
усилительная сигнальная система,
которая может оставаться неповрежденной
при состояниях, характеризующихся
инсули- норезистентностью в условиях
дефектной тирозинкиназной системы и
нарушенного транспорта глюкозы.
Следовательно, при использовании
альтернативной внутриклеточной
сигнальной системы влияние инсулина
на стероидогенез будет сохранено даже
при значительной инсу- линорезистентности.

Идею
о том, что инсулин стимулирует продукцию
андрогенов яичниками путем активации
своих собственных рецепторов,
подтверждают сообщения группы S.
Franks,
показавшей на первичной культуре
гранулезных клеток яичника человека,
что эффекты инсулина на стероидогенез
опосредуются собственными инсулиновыми
рецепторами, а не рецепторами к ИФР-1.
Развитие
ГА при СПЯ можно объяснить стимуляцией
инсулином яичникового цитохрома
Р450с17а, - ключевого фермента биосинтеза
андрогенов в яичниках, который
бифункционален, обладая одновременно
активностью 17а-гидроксилазы и
17,20-лиазы. В тека-клетках яичника
Р450с17а преобразует прогестерон в
17а-гидроксипрогестерон с помощью
своей 17а-гидроксилазной активности,
а затем превращает 17а-гидрокси-
прогестерон в андростендион через
его действие как 17,20-лиазы. Андростендион
преобразуется в тестостерон при
помощи фермента 17-(3 гидроксистероиддегидрогеназы
(схема
2).
Схема
2
Биосинтез
половых стероидов
АКТГЛГ
Холестерин
(лпнп)
Р450
С17 CYP 17 10 хромосома
Д5
Прегненолон
Андроетендиол
Д4
Андроетендиол
17-0Н
Прогестерон
Дезоксикортизол
Зстрадиал
Тикостерон
Кортизол
Минералокортикоиды
! Глюкокортикоиды
Половые
стероиды
Р450
SCC CYP SCC
15 хромосома
11
ft-гидроксилаза
18-гидроксилаза
18-ОН
Кортикостерон |
V зр-гсд 1 | 1 хромосома |
Тесто» |
таршГ^) |
|
J Р450 ароматаза 15 хромосома f 1 ФСГ-зависимая |
17Э-ГСД
7 изознзимов Тип 3 - только в гонадах
В
подпочечниках Д
5-путь
доминирует над Д
4-путем.
В
овариальных клетках теса interna
биосинтез
андрогенов идет преимущественно по Д
4-пути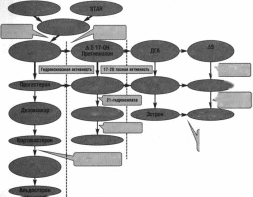

У
многих женщин с СПЯ проявляется
повышенная активность яичникового
цитохрома Р450с17а в виде явного усиления
17а-гидро- ксилазного и, в меньшей мере,
17,20-лиазного действий и это, вероятно,
приводит к излишней продукции
андрогенов в яичниках.
Miller
et
al.
было выявлено сериновое фосфорилирование
Р450с17а у человека. Если один и тот же
фактор, который фосфорилирует серин
инсулинового рецептора, приводя к
ИР, также фосфорилирует серин Р450с17а,
приводя к гиперандрогении, это могло
бы объяснить взаимосвязь СПЯ и ИР
через единственный генетический
дефект.
Основные
патогенетические звенья СПЯ с учетом
роли ИР и ГИ схематично представлен
следующей схеме:
Схема
3
Роль
ИР и ГИ в патогенезе СПЯ |
|
Увеличение количества м-РНК Р450С17 |
|
Повышение синтеза андрогенов в тека-клетках яичников, пролиферация тека-клеток |
4 |
|
Ч, 1 У |
Ж |
|
Активация гена ГИ-РГ |
|
ГИПЕРИНСУЛИНЕМИЯ |
|
ФСГ-стимулированный синтез эстрогенов |
Повышение
свободного
тестостерона
Снижение
синтеза печенью ГСПГ
Таким
образом, ИР и компенсаторная ГИ - ведущие
патогенетические факторы, обуславливающиы
гиперандрогению, включая ее надпочечниковый
компонент. В то же время патогенез СПЯ
не ограничивается только ИР и ГИ.
Возможно, что основной, генетически
обусловленный, фактор - нарушение
цикличности выделения гонадолиберина
(ГнРГ) или нарушение цирхорального
ритма выделения ГнРГ. ГА любого генеза,
так же как и ГИ, усиливает это нарушение.