- •1. Потенциометрическое титрование
- •Принцип метода и требования к реакциям, используемым в потенциометрическом титровании
- •1.2. Способы определения конечной точки потенциометрического титрования
- •2. Лабораторная установка для автоматического титрования
- •2.1 Назначение, устройство и принцип работы
- •2.2. Бюретка автоматическая ба
- •2.3. Иономер эв-74
- •2.4. Блок дифференцирования
- •2.5. Самопишущий потенциометр “tz-4100”
- •2.6. Электродная система
- •3. Блок автоматического титрования бат-15
- •3.1. Устройство и принцип работы
- •3.2. Подготовка к работе автотитратора
- •4. Экспериментальная часть
- •4.1. Индикаторные электроды
- •4.2. Задание первое
- •4.2.1. Подготовка титриметрической установки к работе.
- •4.2.2. Титрование в интегральном режиме с регистрацией кривых титрования в координатах рН-V.
- •4.2.3 Титрование в дифференциальном режиме с регистрацией кривых титрования в координатах ∆рН/∆V
- •4.2.4. Обработка экспериментальных данных.
- •4.3. Задание второе
- •4.3.1. Порядок выполнения работы
- •4.3.2. Выбор положения дозирующей трубки
- •4.3.3. Выбор ширины зоны импульсной подачи раствора
- •4.3.4. Выбор времени выдержки
- •4.3.5. Смена пробы и титрующего раствора
- •4.3.6. Расчет значений рН в точках эквивалентности при кислотно-основном титровании
- •4.3.7. Объекты исследования
- •4.3.8. Порядок титрования
1.2. Способы определения конечной точки потенциометрического титрования
Независимо от техники измерения э.д.с. (компенсационным методом, современным рН-метром или цифровым вольтметром), наиболее распространенным приемом определения к.т.т. в потенциометрии является графический способ. Он заключается в построении интегральной кривой титрования (рис. 1а) в координатах э.д.с. гальванического элемента Е (или потенциал индикаторного электрода) - объем прибавленного раствора титранта V (или количество титранта y).
Точка перегиба (точка, в которой кривая титрования имеет максимальную крутизну в момент “скачка” потенциала) на кривой титрования E=f(V) принимается обычно за к.т.т., которая может совпадать или не совпадать с точкой эквивалентности, но должна быть достаточно близкой к ней и обеспечивать необходимую точность анализа. Несоответствие координат к.т.т. и т.э. возникает в тех случаях, когда определяемые ионы и ионы титранта имеют различные заряды, т.е. стехиометрия реакции отличается от соотношения 1:1. Точка максимального наклона S-образной кривой находится с той стороны от точки эквивалентности, где в избытке присутствует ион с меньшим зарядом. Правильность нахождения т.э. определяется константой равновесия протекающей при титровании химической реакции и быстротой достижения равновесия химической и электродной реакции. При уменьшении этих параметров ошибка титрования возрастает.
Для нахождения точки перегиба обычно проводят две параллельные касательные к пологим нижней и верхней ветвям кривой и соединяют их прямой так, чтобы точка пересечения ее с кривой титрования делила эту прямую на две равные части (точка А, рис. 1г).
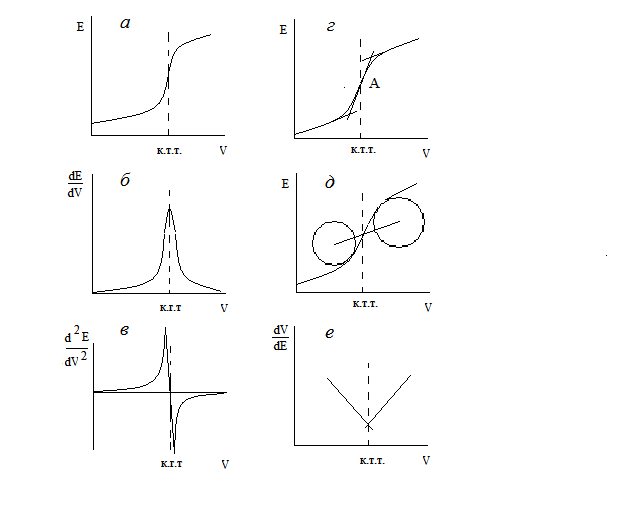
Рис.1. Формы кривых потенциометрического титрования и методы определения конечной точки титровании (к.т.т.):
а – интегральная кривая; б – дифференциальная кривая по первой производной; в – дифференциальная кривая по второй производной; г – метод определения к.т.т. построением касательных; д – метод концентрических дуг; е – метод Грана
Имеются и другие геометрические способы нахождения точки перегиба. Например, метод определения точки пересечения кривой титрования с прямой линией, соединяющей центры двух окружностей, наилучшим образом согласующихся с закругленными верхней и нижней частями кривой титрования (рис. 1д).
В случае, если скачок на кривой титрования размыт и определение к.т.т. затруднено (например, при малых значениях констант равновесия химических реакций), пользуются построением графической зависимости первой или второй производной потенциала от объема титранта. В первом случае к.т.т. соответствует максимальное значение dE/dV (рис. 1б), во втором – значение d2E/dV2, равное нулю (рис. 1в).
Интегральная и дифференциальные кривые титрования могут быть получены вручную или автоматически. В последнем случае используют автоматическую бюретку, ленточно-диаграмный самописец, блок электронного дифференцирования. Автоматические бюретки представляют собой шприцы, поршень которых приводится в движение электродвигателем. Чаще всего используются бюретки, подающие титрант с постоянной скоростью, синхронизированной с протяжкой ленты самописца. Существуют также титраторы, в которых применяются бюретки с изменяемой (регулируемой) скоростью подачи титранта и двухкоординатные самописцы.
Использование автоматического титрования, исключает ошибку, неизбежную при построении интегральных и дифференциальных кривых титрования.
Расчетный графический метод Грана основан на линеаризации кривых титрования. Кривая титрования вблизи от точки эквивалентности трансформируется в две линейные ветви, точка пересечения которых в идеальном случае совпадает с т.э. |
|
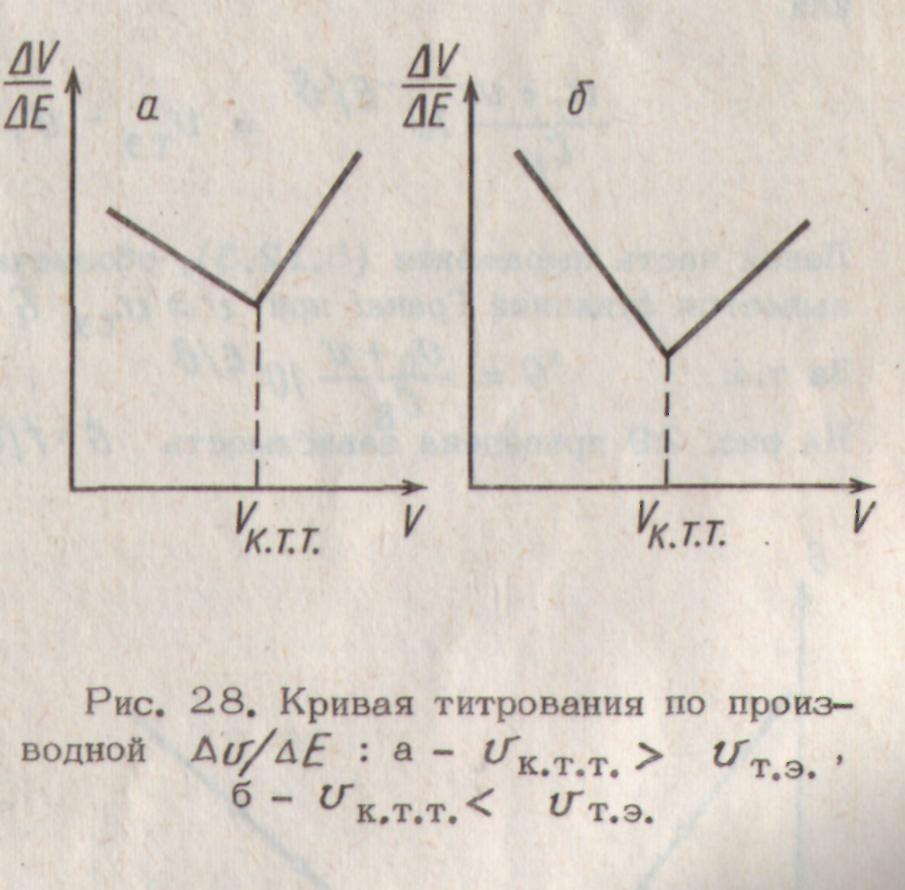
|
Рис. 2. Кривая титрования по производной ΔV/ΔE: a −Vк.т.т.>Vт.э.; б − Vк.т.т.<Vт.э.; |
Титрование до заданного потенциала, отвечающего точке эквивалентности (Ет.э.). Для осуществления такого титрования необходимо либо рассчитать Ет.э., пользуясь уравнениями кривых титрования для различных типов реакций, либо определить этот потенциал экспериментально. Зная Ет.э. индикаторного электрода и потенциал электрода сравнения Еэ.с., находят э.д.с. электродной системы, и титруют испытуемый раствор до достижения этого значения э.д.с.. Если расчет потенциала Ет.э. по каким либо причинам невозможен, то э.д.с. электродной системы измеряют в стехиометрическом стандартном растворе, состав которого идентичен составу исследуемого раствора в точке эквивалентности,