
- •2. Принцип относительности в классической механике. 1 з-н Ньютона. Исо. Принцип относительности Галилея, их следствия. Инвариантные и неинвариантные величины.
- •3. Классическая динамика мт. Взаимодействие тел. Понятие силы и массы. Силы в механике. Законы Ньютона. Границы их применимости. Принцип причинности в классической динамике.
- •4. Закон сохранения полной механической энергии. Механическая работа. Кинетическая и потенциальная энергия. Закон сохранения механической энергии
- •6.Закон сохранения момента импульса.
- •7. Закон всемирного тяготения. Открытие Ньютоном закона всемирного тяготения. Опыты Кавендиша. Инертнаяигравитационная массы. Гравитационное поле. Гравитационное взаимодействие в природе.
- •8. Движение частиц в центральном поле. Центральные поля. Задача двух тел и приведенная масса. Задача Кеплера.Космические скорости.
- •Задача двух тел. Приведённая масса.Кеплерова задача.
- •9. Механические колебания. Характеристики колебательного движения. Свободные и вынужденные колебания линейного гармонического осциллятора. Колебания при наличии трении. Резонанс
- •10. Движ-е в неинерциальных со. Нисо. Силы инерции в поступательно движ-ся системе. Принцип эквивалентности сил инерции и сил тяготения.
- •12. Основы мкт теории газов. Основное уравнение мкт. Статистическое истолкование температуры и давления. Уравнение менделеева-клапейрона. Изотермы реального и идеального газа.Уравнение вдв.
- •13 Теплоемкость газов и тв тел.
- •14 Распределение Максвела–Больцмана.
- •15.Второе начало термодинамики.
- •16 Фазовые переходы
- •17. Основные законы электростатики.
- •21. Электрический ток в металлах.
- •22. Элементы зонной теории твердого тела.
- •23. Электрический ток в полупроводниках.
- •24. Магнитное поле постоянного тока.
- •25. Вещество в магнитном поле
- •26.Электромагнитная индукция (эи)
- •27. Уравнения Максвелла.
- •28.Перем. Эл. Ток
- •30. Интерференция световых волн
- •35.Специальная теория относительности(сто)
14 Распределение Максвела–Больцмана.
Барометрическая формула для центрально-симметричного поля тяготения. Найдем зависимость давления газа в атмосфере планеты от расстояния до центра в пространстве над поверхностью планеты
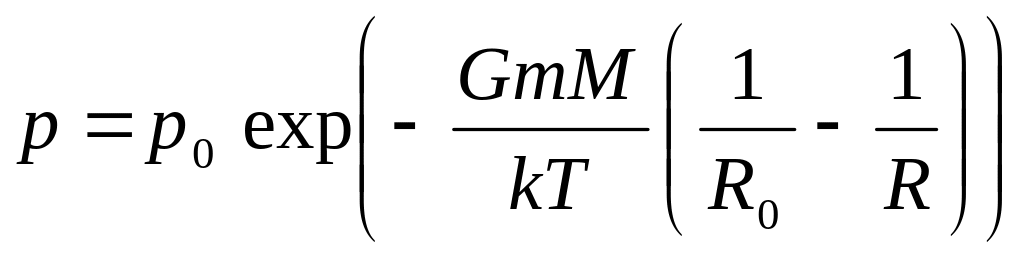
Барометрическая формула. Здесь M – масса планеты, G – гравитационная постоянная, m – масса отдельной молекулы .Это барометрическая формула для центрально-симметричного поля тяготения для пространства R ≥ R0.
Барометрическая формула для однородного поля тяготения. У многих планет газовая оболочка очень тонкая. У Земли, например, она не более 4-5% радиуса. Поэтому при малых перепадах высот изменением напряженности поля тяготения можно пренебречь и считать его постоянным. Формула в этом случае упрощается.
Обозначим R = R0 + h,
где h<<R0. Тогда
![]() и
и
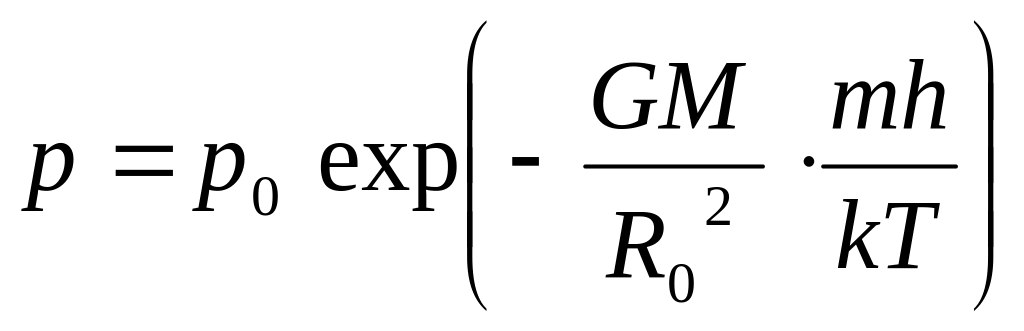 .
Здесь
.
Здесь
![]() -
ускорение силы тяжести на поверхности
планеты.
-
ускорение силы тяжести на поверхности
планеты.![]() .
.
Барометрическая формула для однородного поля тяготения
Распределение Больцмана. Если в барометрической формуле перейти от давления к концентрации по формуле Клаузиуса p = nkT, то получаем закон распределения молекул газа по высоте в однородном поле силы тяжести.
![]() или
или![]() или
или
![]() .
В показатель экспоненты входит
потенциальная энергия молекул в поле
силы тяжести П = mgh. Так
что
.
В показатель экспоненты входит
потенциальная энергия молекул в поле
силы тяжести П = mgh. Так
что
![]() . Распределение
Больцмана,
1866.
. Распределение
Больцмана,
1866.
Р аспред
молекул или каких-то других частиц в
потенциальном силовом поле в услов
теплового равновесия по величине
потенциальной энергии назыв распределением
Больцмана. Физическая
природа силового поля роли не играет. Важно
лишь, чтобы поле было постоянно и
консервативно. Поэтому распред
вида применимо и к другим объектам
природы, например, к эл-м проводимости
в металлах.
аспред
молекул или каких-то других частиц в
потенциальном силовом поле в услов
теплового равновесия по величине
потенциальной энергии назыв распределением
Больцмана. Физическая
природа силового поля роли не играет. Важно
лишь, чтобы поле было постоянно и
консервативно. Поэтому распред
вида применимо и к другим объектам
природы, например, к эл-м проводимости
в металлах.
Функция распределения. Благодаря тому, что молекулы реальн газов имеют конечный объем и потому часто сталк друг с другом, их скорости изменяются. Но оказывается, что в любой момент времени распределение молекул по скоростям, как показывают теория и опыт, вполне опред и единственно возможное.
Задачу о распределении молекул по скоростям можно сформулировать так: какая часть молекул обладает скоростями, лежащими в некотором интервале вблизи заданной скорости.
Р ассмотрим
газ в некотором объеме, в котором
отсутствуют силовые поля. Пусть
n
– концентрация молекул, то есть число
молекул в единице объема, а dn/n
– доля тех молекул, скорости которых
лежат в интервале значений от u
до u + du,
где du
– ширина интервала скоростей. Очевидно,
что чем шире интервал du,
тем больше доля молекул, чьи скорости
в нем заключены, dn/n ~ du.
ассмотрим
газ в некотором объеме, в котором
отсутствуют силовые поля. Пусть
n
– концентрация молекул, то есть число
молекул в единице объема, а dn/n
– доля тех молекул, скорости которых
лежат в интервале значений от u
до u + du,
где du
– ширина интервала скоростей. Очевидно,
что чем шире интервал du,
тем больше доля молекул, чьи скорости
в нем заключены, dn/n ~ du.
Можно предположить, что коэффициент пропорциональности между этими величинами для разных скоростей разный и является функцией скорости u. Тогда соотношение переходит в равенство. dn/n =f(u)du.
Ф ункцию
f(u)
называют функцией
распределения. Ее
нашел теоретически Джеймс Максвелл в
1859 г.
ункцию
f(u)
называют функцией
распределения. Ее
нашел теоретически Джеймс Максвелл в
1859 г. ![]() . Функция
распределения, Дж. Максвелл, 1859
. Функция
распределения, Дж. Максвелл, 1859
Здесь B = m2kT, A = 4π(m2πkT)3 2= 4π(Bπ)3 2, где m – масса каждой молекулы, T – абсолютная температура газа, k – постоянная Больцмана. Функция получена методами теории вероятностей на основе гипотезы о равновероятности всех направлений скоростей молекул.
Максвелловское распределение молекул по скоростям является равновесным. Каково бы ни было распределение в начальный момент времени, оно все равно в конечном счете перейдет в максвелловское f(u). Это доказал Больцман в 1871 г.
U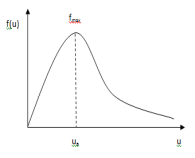 в
- это
скорость, на которую приходится максимум
функции распределения f(u).
в
- это
скорость, на которую приходится максимум
функции распределения f(u).
![]()
![]()
Опыты Штерна. Прямой проверочный эксперимент поставил впервые Отто Штерн в 1920 г. с помощью атомных пучков.
Д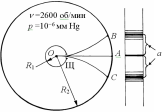 ва
коаксиальных жестко связанных между
собой цилиндра радиусами R1
и R2
вращались с угловой скоростью ω
сначала в одну сторону, затем в
другую. Платиновая нить, покрытая
серебром и натянут вдоль геометр оси
цилиндров, нагревалась до температуры
около 1300 K. При
этом серебро испарялось. (Tпл
серебра 1235 К). Часть испар-ся
атомов серебра, пройдя через щель Щ,
формировали узкий пучок. Скорость
v
движения атомов в этом пучке находилась
так.
ва
коаксиальных жестко связанных между
собой цилиндра радиусами R1
и R2
вращались с угловой скоростью ω
сначала в одну сторону, затем в
другую. Платиновая нить, покрытая
серебром и натянут вдоль геометр оси
цилиндров, нагревалась до температуры
около 1300 K. При
этом серебро испарялось. (Tпл
серебра 1235 К). Часть испар-ся
атомов серебра, пройдя через щель Щ,
формировали узкий пучок. Скорость
v
движения атомов в этом пучке находилась
так.
За время движения атомов между цилиндрами t = (R2 R1)/v цилиндры поворачиваются на угол =t = (R2 R1)/v. Атомный осадок на внутренней стенке большого цилиндра смещается относительно центральной проекции щели (точка А) в точки B или C на расстояние a = R2= R2(R2 R1)/v. Отсюда находится скорость движения атомов в пучке.
![]() .
Штерн получил из опытов v 600 м/с
для атомов серебра при температуре нити
1300 К. Это качественно согласуется
с распределением Максвелла. Наиболее
вероятная скорость для атомов серебра
.
Штерн получил из опытов v 600 м/с
для атомов серебра при температуре нити
1300 К. Это качественно согласуется
с распределением Максвелла. Наиболее
вероятная скорость для атомов серебра
![]() ,
среднеквадратичная скорость
vкв 550 м/с. Если
учесть, что расстояние a
до центра пятна на внутр поверхности
большого цилиндра находилось по
визуальной плотности осадка, это неплохое
соответствие теории эксперименту.
,
среднеквадратичная скорость
vкв 550 м/с. Если
учесть, что расстояние a
до центра пятна на внутр поверхности
большого цилиндра находилось по
визуальной плотности осадка, это неплохое
соответствие теории эксперименту.
Сравнение осадка в точке A, полученного при покоящихся цилиндрах, с осадками в точках B и C показало, что если края полосы в точке A резко очерчены, а осадок в пределах полосы однородный, то края полос B и C размыты, плотность осадка убывает от середины к краям. Это говорит о том, что скорости атомов в пучке разные.
Недостаток первых опытов Штерна состоял в том, что атомы серебра выходили не из газа, а с поверхности твердого тела. Поэтому они несли информацию о распределении скоростей не в газе, а в твердом теле.
