
- •Введение.
- •Глава 1. Общие понятия и определения.
- •§1. Предмет и термодинамический метод исследования.
- •§2. Термодинамическое рабочее тело и его основные параметры состояния
- •Температура газа.
- •§3. Идеальный газ.
- •§4 Идеальные газовые смеси
- •Глава 2. Первый закон термодинамики.
- •§1 Внутренняя энергия системы.
- •§2 Первый закон термодинамики
- •1 Закон в конечном виде применим к конечному процессу 1-2:
- •§3 Анализ первого закона термодинамики.
- •§4 Связь количеств механического и теплового взаимодействий с основными параметрами газа.
- •Механическое взаимодействие:
- •Тепловое взаимодействие
- •§5 Теплоемкость идеального газа.
- •§6 Внутренняя энергия и энтальпия. Внутренняя энергия
- •Энтальпия
- •§7. Обратимые и необратимые процессы.
- •Глава 3. Газовые процессы.
- •§1Политропные методы исследования процесса.
- •§2 Порядок исследования политропного процесса.
- •А) Связь между начальными и конечными параметрами газа
- •Б) Связь между начальными и промежуточными параметрами.
- •В) Работа газа за процесс.
- •Д) Теплота, подводимая (отводимая) к газу за процесс
- •Е) Теплоемкость газа за процесс
- •Ж) Показатель политропы “n”
- •§3 Связь энтропии с основными параметрами газа
- •§4 Изотермический процесс.
- •§5 Изобарный процесс.
- •§6 Изохорный процесс.
- •§7 Адиабатический процесс.
- •§8 Обобщающие значения политропного процесса.
- •§9 Пример исследования политропного процесса.
Д) Теплота, подводимая (отводимая) к газу за процесс
Для определения теплоты в процессе существуют три формулы:
1) dq = TdS - по этой формуле теплота не рассчитывается, она существует лишь для построения тепловой диаграммы
2) dq = CndT - рассчитывается теплота, если известно теплоемкость Cn
3) dq=du+dl
q= ∆u +l (15)
Е) Теплоемкость газа за процесс
q= ∆u +l (а)
dq
сn = dT => dq = сndT ;
q = сn(T2 - T1)
∆u =cv(T2-T1)
R
l = 1-n
(T2
– T1)
= 1-n
(T2
– T1)
Подставляем в (а) 1), 2), 3):


 R
R
c n(T2
– T1)
= cv(T2
– T1)
+ 1-n (T2
– T1)
n(T2
– T1)
= cv(T2
– T1)
+ 1-n (T2
– T1)
 R
R
cn = cv + 1-n (16) (n≠1, т.е. эта формула не подходит к изотермическому процессу)
Так как сv, R, n = const, то для данного процесса значит сn = const
Ж) Показатель политропы “n”
p1v1n =p2v2n
p 1
=
v2
n
1
=
v2
n
p2 v1
p1 p1
n = log p2 = ln p2
 v2
v1
(17)
v2
v1
(17)
log v1 ln v2
§3 Связь энтропии с основными параметрами газа
dq=Tds
![]() Отсюда
видно, что т.к. T
– параметр состояния, а сn
= сonst,
то и s
– тоже параметр состояния.
Отсюда
видно, что т.к. T
– параметр состояния, а сn
= сonst,
то и s
– тоже параметр состояния.

![]()
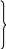 T2
T2
∆s1-2 = cn ln T1
∆s1-2 = s2 – s1 (1)
∆s2 = s1 + ∆s1-2
Для построения кривой процесса необходимо знать параметры в промежуточных точках. Для этого задаются значения температур Тх1, Тх2 , Тх3, и по формуле (1) определяют энтропию sx1, sx2, sx3 .
Tx1
∆s1-x1= cn ln T1 (2) , где ∆s1-x1 = sx1 – s1 ; sx1 = s1 + ∆s1-x1
Формулы (1) и (2) справедливы лишь для политропных процессов, где cn - const . Если неизвестно политропный – ли процесс, необходимо использовать другие связи энтропии с основными параметрами газа.
 dq
по
1 закону
du+pdv
dq
по
1 закону
du+pdv
d s=
T
ds
= T
s=
T
ds
= T
 dT
p
dT
p
dq = du + dl ds = cv T + T dv
dl = pdv
p R
d u
= cvdT
pv = RT T = v
u
= cvdT
pv = RT T = v

dT dv
ds = cv T + R v (a)
Найдены связи энтропии с другими основными параметрами
[s = ƒ(T,υ)] [ s = ƒ(T,p)]
Воспользуемся уравнением состояния в дифференциальной форме.
pv=RT
→![]()
pdv + vdp = RdT |: υ,p
dv dp dT
v + p = T (б)
Заменим в уравнении (а) температуру, используя уравнение (б)
dv dp dv
ds = cv v + cv p + R v
dV dp
ds = cp V + cv p (в) [s = ƒ(p;v)]
Заменим в (а) объемы, используя (б):
dT dT dp
ds = cv T + R T - R p
dT dp
ds = cp T - R p (г)
И получаем:
Проинтегрировав
уравнение (а)
∆s1-2 = CvlnT1 + R lnv1 (3)
Проинтегрировав
уравнение (б)
∆s1-2 = Cpln v1 + Cv ln p1 (4)
Проинтегрировав
уравнение (в)
∆s1-2 = Cpln T1 - R ln p1 (5)
∆s1-2 = s2 – s1
s2 = s1 + ∆s1-2
Для определения s1 используют понятие условный нуль. Условно считают, что при нормальных физических условиях энтропия s0=0
p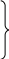 0
= 1.0336•105
Па
0
= 1.0336•105
Па
T0 = 273 K нормальные физические условия.
s0 = 0
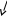 T1
p1
T1
p1
∆s0-1 = s1 – s0 = s1 = cp ln T0 – R ln p0
0
