
- •Введение.
- •Глава 1. Общие понятия и определения.
- •§1. Предмет и термодинамический метод исследования.
- •§2. Термодинамическое рабочее тело и его основные параметры состояния
- •Температура газа.
- •§3. Идеальный газ.
- •§4 Идеальные газовые смеси
- •Глава 2. Первый закон термодинамики.
- •§1 Внутренняя энергия системы.
- •§2 Первый закон термодинамики
- •1 Закон в конечном виде применим к конечному процессу 1-2:
- •§3 Анализ первого закона термодинамики.
- •§4 Связь количеств механического и теплового взаимодействий с основными параметрами газа.
- •Механическое взаимодействие:
- •Тепловое взаимодействие
- •§5 Теплоемкость идеального газа.
- •§6 Внутренняя энергия и энтальпия. Внутренняя энергия
- •Энтальпия
- •§7. Обратимые и необратимые процессы.
- •Глава 3. Газовые процессы.
- •§1Политропные методы исследования процесса.
- •§2 Порядок исследования политропного процесса.
- •А) Связь между начальными и конечными параметрами газа
- •Б) Связь между начальными и промежуточными параметрами.
- •В) Работа газа за процесс.
- •Д) Теплота, подводимая (отводимая) к газу за процесс
- •Е) Теплоемкость газа за процесс
- •Ж) Показатель политропы “n”
- •§3 Связь энтропии с основными параметрами газа
- •§4 Изотермический процесс.
- •§5 Изобарный процесс.
- •§6 Изохорный процесс.
- •§7 Адиабатический процесс.
- •§8 Обобщающие значения политропного процесса.
- •§9 Пример исследования политропного процесса.
§6 Изохорный процесс.
Изохорный процесс называется процесс протекающий при постоянном объеме т.е. V=const; dV=0; dV/V→0
График процесса называется изохорой который в P-V координатах имеет вид прямой линии.
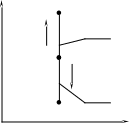 p 2
p 2
n= – ∞
dT>0
1
n=+∞
dT<0
2
0 v
Определим показатель политропы:
n =lg(P2/P1)/lg(v1/v2) т.к. v1=v2 (число/0) то n = ± ∞
Установим связь между параметрами газа:
т.1 p1v1=RT1
т.2 p2v2=RT2
(p1v1)/(p2v2)=T1/T2 => v1=v2 => p1/p2=T1/T2
Работа:
dl= pdv; dv=0
dl=0; l=0
Изменение внутренней энергии
Δu=cv(T2-T1) Δu1-2=u2-u1
Изменение энтальпии за процесс:
Δi1-2=cp(T2-T1) Δi1-2=i2-i1
Количество теплоты:
q=Δu+l; l=0
q=Δu
Изменение энтропии:
dS= cndT/T; cn=cv
ΔS1-2=cvln(T2/T1); ΔS1-2=S2-S1 S2=S1+ ΔS
Определим теплоемкость газа.
Cn=cv+R/1-n n = ± ∞ cn=cv
Рассмотрим изохорный процесс в тепловой диаграмме
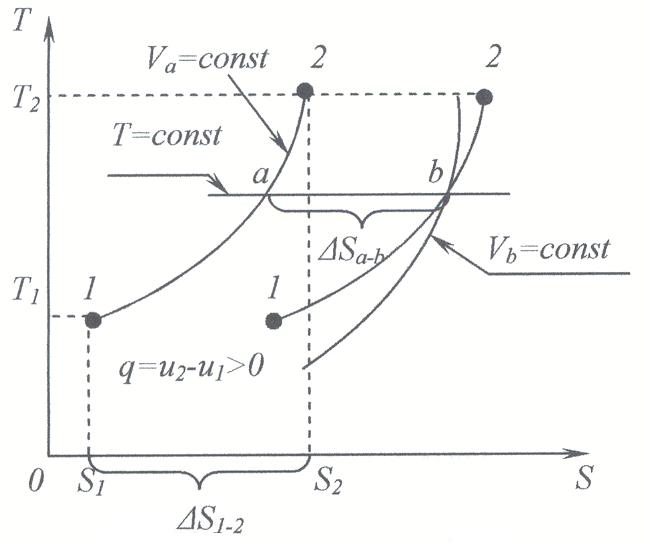
Рассмотрим взаимное расположение изохор. Проведем через точку а изотерму.
Пусть vb>va . Определим в какую сторону и величину сместится точка b по изотерме.
s=f(T,v)
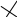
ds = cvdT/T+Rdv/v Δsa-b = sb-sa = Rln(vb/va)
0
Т.к. vb>va то получаем что:
Δsa-b>0 sb>sa
Проведя аналогичные построения для других точек, получим ту же самую величину Δsa-b = Rln(vb/va); получим таким образом кривую, параллельную данной.
Изохоры в T-s координатах изображаются логарифмическими (эквидистантными) кривыми, причем с увеличением v изохора смещается вправо по оси s.
§7 Адиабатический процесс.
Адиабатическим процессом называется процесс, протекающий без теплообмена газа с окружающей средой.
dq=0 dl=-du dq= du+dl
Вывод уравнения адиабатического процесса:
dl= -du; pdv=-cvdT;
Умножим и разделим левую часть этого уравнения на υ,а правую – на T
pv(dv/v)=-cvT(dT/T);
RT(dv/v)=-cvT(dT/T) (а)
Воспользуемся уравнением состояния в дифференциальной форме.
dp/p+dv/v=dT/T (б)
Заменим в уравнении (а) dT/T, используя формулу (б)
![]()
R(dv/v)+cv(dv/v)+cv(dp/p)=0; (в)
![]()
Т.к. R+cv=cp; то cp(dv/v)+cv(dp/p)=0; | : Сv
(cp/cv)(dv/v)+dp/p=0;
cp/cv=k – показатель адиабаты
k(dv/v)+dp/p=0;
ИЛИ:
lnvk+lnp=const; lnpvk=const
pvk=const уравнение адиабатного процесса.
Для 1 атомных газов k=1,6
Для 2х атомных газов k=1,4
Для 3х атомных газов k=1,33
Уравнение политропного процесса: pvn=const. Значит, для адиабатного процесса:
n=k k=const k=cp/cv
pvk=const => p=const/vk, k>1←неравнобокая гипербола
Сравним это уравнение p=const/vk с уравнением изотермы p=const/v, т.е.сравним неравнобокую гиперболу с равнобокой:
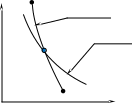 2
2
p адиабата
T=const
Поскольку k>1 то адиабата 1
в p-v координатах изображается более крутой.
2
v
Связь между начальными и конечными параметрами, начальными и промежуточными, а также работу газа определяют по формулам §2 этой главы. Где вместо n подставляют k.
Работу газа в адиабатном процессе можно определить по более простой формуле:
l1-2= -Δu1-2= -cv(T2-T1)=cv(T1-T2) - если температура газа падает, то происходит процесс расширения; если температура повышается – то процесс сжатия.
Δu1-2=u2-u1=cv(T2-T1)
Δi1-2=i2-i1=cp(T2-T1)
q=0
теплоемкость:
cn=dq/dT=0/число
cn=0
изменение энтропии:
ds=dq/dT
dq=0
Δs1-2=s2 -s1=0
s2=s1 или s=const
Адиабатный процесс называют еще изоэнтропным (т.е. при постоянной энтропии)
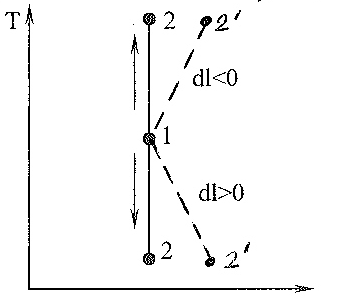 Рассмотрим
адиабатный процесс в тепловой диаграмме:
Рассмотрим
адиабатный процесс в тепловой диаграмме:
Реальные адиабатные процессы протекают с трением.
Реальные адиабатные процессы называют еще псевдоадиабатными.
Для них:
ds=dqr/T>0; dqr>0
s
