
- •Введение.
- •Глава 1. Общие понятия и определения.
- •§1. Предмет и термодинамический метод исследования.
- •§2. Термодинамическое рабочее тело и его основные параметры состояния
- •Температура газа.
- •§3. Идеальный газ.
- •§4 Идеальные газовые смеси
- •Глава 2. Первый закон термодинамики.
- •§1 Внутренняя энергия системы.
- •§2 Первый закон термодинамики
- •1 Закон в конечном виде применим к конечному процессу 1-2:
- •§3 Анализ первого закона термодинамики.
- •§4 Связь количеств механического и теплового взаимодействий с основными параметрами газа.
- •Механическое взаимодействие:
- •Тепловое взаимодействие
- •§5 Теплоемкость идеального газа.
- •§6 Внутренняя энергия и энтальпия. Внутренняя энергия
- •Энтальпия
- •§7. Обратимые и необратимые процессы.
- •Глава 3. Газовые процессы.
- •§1Политропные методы исследования процесса.
- •§2 Порядок исследования политропного процесса.
- •А) Связь между начальными и конечными параметрами газа
- •Б) Связь между начальными и промежуточными параметрами.
- •В) Работа газа за процесс.
- •Д) Теплота, подводимая (отводимая) к газу за процесс
- •Е) Теплоемкость газа за процесс
- •Ж) Показатель политропы “n”
- •§3 Связь энтропии с основными параметрами газа
- •§4 Изотермический процесс.
- •§5 Изобарный процесс.
- •§6 Изохорный процесс.
- •§7 Адиабатический процесс.
- •§8 Обобщающие значения политропного процесса.
- •§9 Пример исследования политропного процесса.
§6 Внутренняя энергия и энтальпия. Внутренняя энергия
Первый закон термодинамики:
dq=du+dl
dl=pdv.
Рассмотрим процесс при постоянном объеме: v=const
Тогда: dv=0, dl=0 и имеем
(dq)v=const=du (a).
С другой стороны, количество теплоты в этом процессе можно определить по теплоемкости:
(dq)v=const=сvdT (б),
где сv – это теплоемкость газа в процессе при постоянном v=const (где индекс «ν» в Cv - взят вместо индекса «n».)
В уравнениях (a) и (б)- левые части одинаковы. Поэтому равны и их правые части:
du=сvdT =>
∆u =cv∆T
∆u =u 2-u 1 u 1=cv T1
ИЛИ: u 2-u 1= cv(T2-T1) =>
∆T=T2-T1 u 2= cvT2
∆u =cv(T2-T1) (1)
u =cvT (2)
Из формул (1) и (2) видно, что внутренняя энергия для идеального газа является функцией температуры и расчетные формулы (1) и (2) справедливы для любых процессов в идеальных газах.
Внутренняя энергия системы, рабочим телом которой является идеальный газ, зависит только от температуры.
Cv=711,8 Дж/кг К≈712 Дж/кг К.
Энтальпия
Энтальпия- параметр состояния, и в частных случаях процесса при р=const представляет собой теплосодержание газа.
Рассмотрим процесс при р=const.
Первый закон термодинамики:
dq=du+dl, где
d l =pdυ.
Рассмотрим дифференциал d(pυ)= pdυ + υdp; =>
pdυ= d(pυ) – υdp=dl.
Тогда: dq=du+ d(pυ) – υdp.
При р=const: dp=0, v∙dp=0 (1)
Тогда уравнение приобретает вид:
(dq)p=const=du+d(pv)=d(u+pv)=di (2)
где (u+pv)= i т.е. (dq)p=const= d i.
i=u+pv (3)-энтальпия
u-параметр состояния, р – параметр состояния, следовательно I – тоже будет параметром состояния.
Энтальпия представляет сумму внутренней энергии системы и работы, затраченной на помещение системы в данную точку пространства:
(dq)p=const=di (a)
Частный случай при исследовании 1 закона термодинамики: теплота, подводимая к газу при p=const идет на изменение энтальпии. Отсюда видно, что энтальпия - это теплосодержание газа в процессе при постоянном давлении.
Исследуем формулу (3):
u=сvT
pv=RT. Тогда i=u+pv= сvT+RT. Или:
i=(сv+R)T (б)
С другой стороны, по теплоемкости можно определить количество теплоты при постоянном давлении:
(dq)p=const=срdT (в)
где индекс «р» взят вместо индекса «n» и говорит о том, что ср – теплоемкость газа при постоянном давлении. “p”→”n”
В уравнениях (а) и (в) левые части одинаковы, => одинаковы и правые части => получаем уравнение (в’):
di=cpdT (в‘)
∆i=сp(T2-T1) (7)
∆i=i2-i1
qp=const=∆i=i2-i1 (4). Эта формула (4) является частным случаем 1-ого закона термодинамики.
i=сpT (5)
Из этого уравнения видно, что т.к. Т – параметр состояния, а сp – постоянная, то энтальпия – тоже параметр состояния.
Энтальпия идеальных газов зависит только от температуры.
Сравним уравнение (5) и (б):
сp=сv+R (6) -уравнение Майера.
R-работа, которую совершает 1кг газа при нагревании его на 1К в процессе при постоянном давлении.
R=287Дж/кгК
сp=712+287=999Дж/кгК≈1кДж/кгК
§7. Обратимые и необратимые процессы.
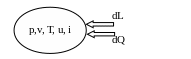
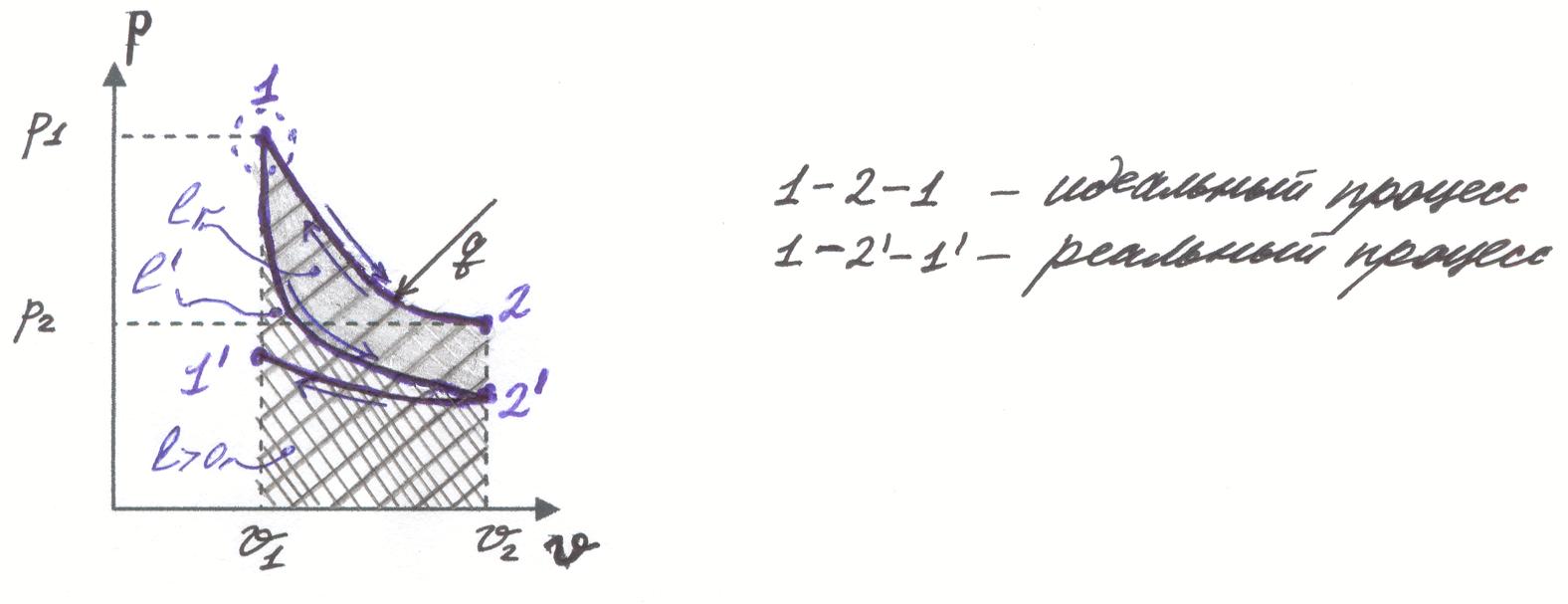
Поршень движется ( нарушено механическое равновесие)
p
Пусть система находится в состоянии покоя, т.е.абсолютно изолирована, все параметры газа равномерно распределены по объему системы. Такое состояние системы можно охарактеризовать точкой 1в p-v координатах (см рис 1). При снятии изоляции с системы, например при нагревании газа, нарушается тепловое равновесие, т.к.Т газа около ограничивающей поверхности всегда выше, чем в центре системы, аналогично при механическом взаимодействии нарушается механическое равновесие, например при сжатии газа давление газа около поршня больше, чем в центре системы (т.к.волны сжатия и расширения перемещаются со скоростью звука).
Такое неравновесное состояние газа нельзя охарактеризовать точкой 1, около точки 1 получим семейство точек. Чтобы иметь возможность графически исследовать и рассчитать процесс, необходимо допустить бесконечно малые «порции» dQ и dL- взаимодействий и вновь изолировать систему. Система приходит в новое состояние равновесия, которое можно охарактеризовать одной точкой, близкорасположенной к точке1. В итоге мы получаем линию процесса 1-2.
Процессы, в которых параметры газа, изменяясь во времени остаются одинаковыми по объему системы называются квазистатическими (как будто статические). Квазистатические процессы - это идеальные обратимые процессы, которые протекают без трения между молекулами.
Обратимые – процессы, в которых параметры газа, как в прямом, так и в обратном направлении проходят через одни и те же промежуточные состояния.
Условия обратимости процесса.
Наличие теплового равновесия.
Наличие механического равновесия.
Отсутствие трения между молекулами газа.
Все реальные процессы являются необратимыми, т.к. у них отсутствуют 3 условия
1-2’- реальный (необратимый процесс)
l’=l-lr - действительная работа в необратимом процессе
lr - работа трения. Работа трения в конечном счете преобразуется в теплоту трения: lr= qr>0, которая всегда воспринимается (т.е. поглощается) газом.
Реальные необратимые процессы в p-v координатах расположены ниже идеальных. Первый закон термодинамики для реальных процессов имеет вид:
q+qr=∆u+l’
В дальнейшем будем изучать идеальные, обратимые процессы.
В тех случаях, когда необходимо учесть необратимость процесса вводится специальный поправочный коэффициент, который находится из опыта.
