
- •Введение.
- •Глава 1. Общие понятия и определения.
- •§1. Предмет и термодинамический метод исследования.
- •§2. Термодинамическое рабочее тело и его основные параметры состояния
- •Температура газа.
- •§3. Идеальный газ.
- •§4 Идеальные газовые смеси
- •Глава 2. Первый закон термодинамики.
- •§1 Внутренняя энергия системы.
- •§2 Первый закон термодинамики
- •1 Закон в конечном виде применим к конечному процессу 1-2:
- •§3 Анализ первого закона термодинамики.
- •§4 Связь количеств механического и теплового взаимодействий с основными параметрами газа.
- •Механическое взаимодействие:
- •Тепловое взаимодействие
- •§5 Теплоемкость идеального газа.
- •§6 Внутренняя энергия и энтальпия. Внутренняя энергия
- •Энтальпия
- •§7. Обратимые и необратимые процессы.
- •Глава 3. Газовые процессы.
- •§1Политропные методы исследования процесса.
- •§2 Порядок исследования политропного процесса.
- •А) Связь между начальными и конечными параметрами газа
- •Б) Связь между начальными и промежуточными параметрами.
- •В) Работа газа за процесс.
- •Д) Теплота, подводимая (отводимая) к газу за процесс
- •Е) Теплоемкость газа за процесс
- •Ж) Показатель политропы “n”
- •§3 Связь энтропии с основными параметрами газа
- •§4 Изотермический процесс.
- •§5 Изобарный процесс.
- •§6 Изохорный процесс.
- •§7 Адиабатический процесс.
- •§8 Обобщающие значения политропного процесса.
- •§9 Пример исследования политропного процесса.
Глава 3. Газовые процессы.
§1Политропные методы исследования процесса.
Процессы, протекающие в устройствах, в общем случае имеют сложную зависимость между параметрами состояния.(см рисунок)
В термодинамике исследуются лишь специальные, простейшие процессы, для которых разработан математический аппарат. Такие процессы записываются в виде: pvⁿ = const, и называются политропными, где “n”- показатель политропности. Для данного процесса n=const, в целом -<n<+. Таким образом разбивая сложную зависимость наряд сложных участков, подбором показателя политропы n можно исследовать любые сложные термодинамические процессы.
В дальнейшем мы будем исследовать политропные обратимые термодинамические процессы.
§2 Порядок исследования политропного процесса.
Начальные параметры газа обычно задаются, а конечные (в точке 2) известны не все – их и следует найти
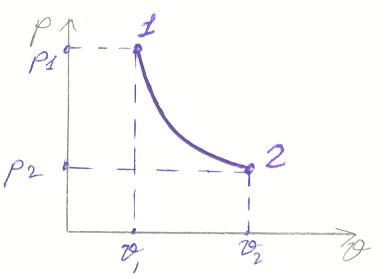
А) Связь между начальными и конечными параметрами газа
pvⁿ = const
Tочка1 p1v1ⁿ = const
Tочка2 p2v2ⁿ = const
p1v1ⁿ = p2v2ⁿ
|
(1) или |
v2 p1 1/n v1 = p2 |
(2) |
Установим связь между другими параметрами.
Точка1 p1v1= RT1
Tочка2 p2v2= RT2
(p1/p2)(v1/v2) = T1/T2 (*)
заменим в уравнении давления, используя формулу (1):
(v1/v2)ⁿ∙(v1/v2) = T1/T2
(v1/v2)1-n=T1/T2 |
(3) или |
v1 T1 _1__ v2 = T2 1-n |
(4) |
В формуле (*) заменим в уравнении объемы, используя формулу (2)
P1/P2∙(P2/P1)1/n = T1/T2
n-1 (p1/p2) n = T1/T2 |
(5) или |
n p1/p2 = (T1/T2)n-1 |
(6) |
Б) Связь между начальными и промежуточными параметрами.
Для построения кривой процесса необходимо знать параметры газа в промежуточных точках, для этого выбирают 2-3 точки: vx1, vx2, vx3 . и по формуле (1) определяют соответствующие значения рx1, рx2, рx3 , в некоторых точках х1,х2,х3.
Формула (1): P

 P1
1
P1
1
P 1
V2
n
Px1
x1
1
V2
n
Px1
x1
P2 = V1 Тогда:
Px2 x2
P x1 V1
n
Px3
x3
x1 V1
n
Px3
x3
P 1
= Vx1
P2
2
1
= Vx1
P2
2

 V1
n
(7) V
V1
n
(7) V
Px1= P1 Vx1 0 V1Vx1Vx3 Vx3 V2
В) Работа газа за процесс.
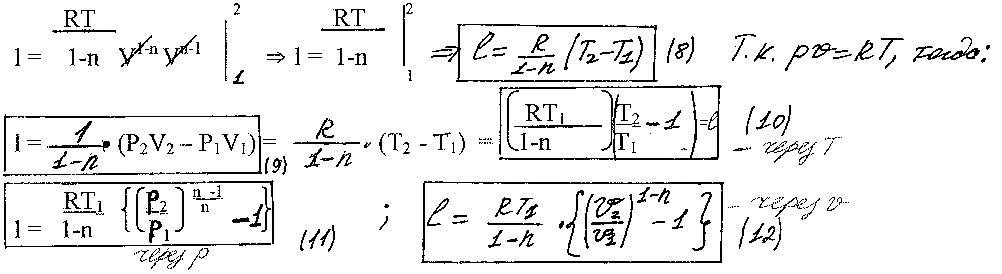
dl = pdυ- для 1 кг l =∫12pdυ; для политропного процесса: p=const/vn
dV
l = const ∫12 Vn ; (n≠1, т.е. рассматриваются все политропные процесс, кроме изотермического)
2
 υ1-n
υ1-n
l = const 1-n
1
Раскроем константу:
рυn = const
pv = RT
pTvn-1 = const
При одинаковых значениях в точках 1 и 2 работа в разных процессах будет различной, т.к. различен показатель n.
Г) Изменение внутренней энергии и энтальпии газа.
1. du=cvdT
Δu1-2=u2-u1=cv(T2-T1) (13)
2. di=cpdT
Δi1-2=i2-i1=cp(T2-T1) (14)

 p1/p2
= (v2/v1)ⁿ
p1/p2
= (v2/v1)ⁿ