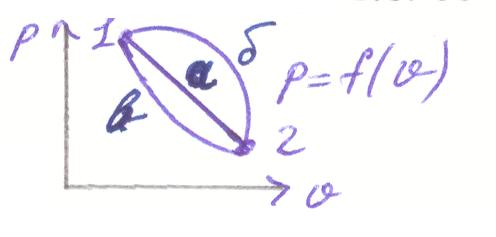- •Введение.
- •Глава 1. Общие понятия и определения.
- •§1. Предмет и термодинамический метод исследования.
- •§2. Термодинамическое рабочее тело и его основные параметры состояния
- •Температура газа.
- •§3. Идеальный газ.
- •§4 Идеальные газовые смеси
- •Глава 2. Первый закон термодинамики.
- •§1 Внутренняя энергия системы.
- •§2 Первый закон термодинамики
- •1 Закон в конечном виде применим к конечному процессу 1-2:
- •§3 Анализ первого закона термодинамики.
- •§4 Связь количеств механического и теплового взаимодействий с основными параметрами газа.
- •Механическое взаимодействие:
- •Тепловое взаимодействие
- •§5 Теплоемкость идеального газа.
- •§6 Внутренняя энергия и энтальпия. Внутренняя энергия
- •Энтальпия
- •§7. Обратимые и необратимые процессы.
- •Глава 3. Газовые процессы.
- •§1Политропные методы исследования процесса.
- •§2 Порядок исследования политропного процесса.
- •А) Связь между начальными и конечными параметрами газа
- •Б) Связь между начальными и промежуточными параметрами.
- •В) Работа газа за процесс.
- •Д) Теплота, подводимая (отводимая) к газу за процесс
- •Е) Теплоемкость газа за процесс
- •Ж) Показатель политропы “n”
- •§3 Связь энтропии с основными параметрами газа
- •§4 Изотермический процесс.
- •§5 Изобарный процесс.
- •§6 Изохорный процесс.
- •§7 Адиабатический процесс.
- •§8 Обобщающие значения политропного процесса.
- •§9 Пример исследования политропного процесса.
1 Закон в конечном виде применим к конечному процессу 1-2:
∫12dq=∫12du+∫12dl
∫12du=u2-u1=∆u - изменение внутренней энергии.
∫12dl=l ( а не ∆l, что не имеет смысла, т.к. работа производится только в том случае, когда протекает процесс) – это не изменение работы, а сама величина ℓ (работа)
∫12dq=q ( а не ∆q, т.к. теплота подводится лишь при протекании процесса) – это q в конечной форме для 1 кг.
Получаем: q=∆u+l
§3 Анализ первого закона термодинамики.
dq=du+dl
1) Пусть du=0
а) Система абсолютно изолирована.
б) dq=dl - процессы, в которых внутренняя энергия газа не изменяется называют изотермическими. Вся подводимая теплота расходуется на совершение работы.
2) Пусть dl=0 (газ находится в замкнутом жестком баллоне)
dq=du – процессы ,протекающие без совершения работы, называют изохорными. Вся подводимая теплота идет на изменение внутренней энергии.
3) Пусть dq=0
- du=dl, т.е. работа совершается за счет внутренней энергии. ИЛИ:
du=- dl, т.е. вся затраченная работа идет на увеличении внутренней энергии.
Процессы, протекающие без теплообмена газа со средой, называются адиабатными.
4) Пусть dq>0
а )
du>0,
dl>0.
)
du>0,
dl>0.
dq=du+dl
подводимая теплота идет на
увеличение внутренней энергии
и совершения внутренней работы.
б) du>0, dl<0
dq=du+dl
в) du<0, dl>0
dq=du+dl
5 ) Пусть dq<0
а) du<0, dl<0.
dq=du+dl
б) du>0, dl<0.
dq=du+dl
в) du<0, dl>0.
dq=du+dl
§4 Связь количеств механического и теплового взаимодействий с основными параметрами газа.
При механическом и тепловом взаимодействиях в системе протекает термодинамический процесс, т.е. изменяются параметры состояния. Свяжем основные параметры состояния с теплотой и работой.
Механическое взаимодействие:
Пусть система находится в состоянии покоя. Все параметры газа равномерно распределены по объему системы. Давление газа всюду одинаково, во всех точках окружности и ограничивающихся поверхности.
 ↑dx
↑dx
При механическом взаимодействии система под воздействием внутреннего избыточного давления расширяется (см.рис.). В общем случае давление изменяется. Чтобы давление не изменялось необходимо дать бесконечно малое расширение системы (dx→0) и изолирование ее от механического воздействия p=const. Тогда по принципу интегральных вычислений:
F=const – площадь ограничивающей поверхности. Тогда элементарная работа равна:
dL =P∙dx, где P=p∙F, а F∙dx=dV
dL=P∙dx=p∙F∙dx=p∙dV.
Работа, связанная с изменением объема, называется работой деформации.
Если dV=0, то
dL=0, L=0 – изохорный процесс
L=Pdv
v=V/M=м3/кг.
Если dV>0, то dL>0. Если dV<0, то dL<0.
Работа за конечный процесс 1-2:
L=∫12dL=∫12рdv.
Работа 1 кг газа равна l=L/M [Дж/кг].
Элементарная работа 1 кг газа: dl=p∙dv
Работа 1кг газа за конечный процесс 1-2:
l=∫12dl=∫12pdv
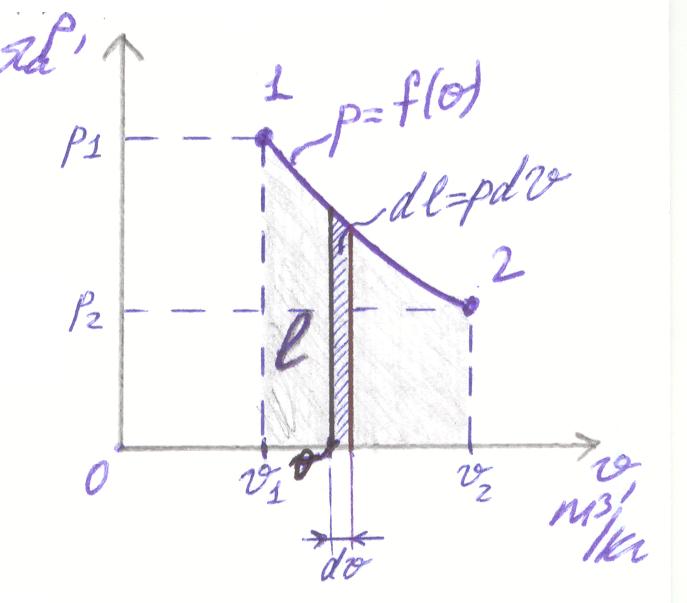
Чтобы взять интеграл ∫12pdv, необходимо знать вид зависимости функции p=f(v).=>
l=∫12dl=∫12pdv=∫12f(v)dv – площадь кривой процесса 1-2 в pv-координатах
Зависимость p=f(v) графически изображается в системе координат, в которой по оси абсцисс взят удельный объем v, а по оси ординат – давление р.
Пусть начальное состояние характеризуется точкой 1 (его параметры известны). Точка 2 – конечное состояние. Определим на графике элементарную работу dl=p∙dv.
Чтобы найти работу l за конечный процесс 1-2, необходимо проссумировать элементарные площадки dl - получим площадь под кривой 1-2. Эта площадь равна работе газа за процесс. Диаграмма p-v, в которой площадь под кривой процесса численно равна работе газа за процесс, называется рабочей диаграммой.
Особенности рабочей диаграммы:
Дает наглядное представление о характере протекания процесса.
Площадь под кривой процесса определяет работу газа за процесс:
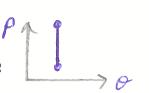 dl
= pdυ
dl
= pdυ
а) dυ>0 (p>0), то d l >0 (l >0)
б) dυ<0, то d l <0 (l <0)
в) dυ=0, υ=const, d l =0 (l =0) изохорный процесс
3) Из рабочей диаграммы видно, что работа является функцией процесса, т.е. ее величина зависит от характера протекания процесса.