
- •Введение.
- •Глава 1. Общие понятия и определения.
- •§1. Предмет и термодинамический метод исследования.
- •§2. Термодинамическое рабочее тело и его основные параметры состояния
- •Температура газа.
- •§3. Идеальный газ.
- •§4 Идеальные газовые смеси
- •Глава 2. Первый закон термодинамики.
- •§1 Внутренняя энергия системы.
- •§2 Первый закон термодинамики
- •1 Закон в конечном виде применим к конечному процессу 1-2:
- •§3 Анализ первого закона термодинамики.
- •§4 Связь количеств механического и теплового взаимодействий с основными параметрами газа.
- •Механическое взаимодействие:
- •Тепловое взаимодействие
- •§5 Теплоемкость идеального газа.
- •§6 Внутренняя энергия и энтальпия. Внутренняя энергия
- •Энтальпия
- •§7. Обратимые и необратимые процессы.
- •Глава 3. Газовые процессы.
- •§1Политропные методы исследования процесса.
- •§2 Порядок исследования политропного процесса.
- •А) Связь между начальными и конечными параметрами газа
- •Б) Связь между начальными и промежуточными параметрами.
- •В) Работа газа за процесс.
- •Д) Теплота, подводимая (отводимая) к газу за процесс
- •Е) Теплоемкость газа за процесс
- •Ж) Показатель политропы “n”
- •§3 Связь энтропии с основными параметрами газа
- •§4 Изотермический процесс.
- •§5 Изобарный процесс.
- •§6 Изохорный процесс.
- •§7 Адиабатический процесс.
- •§8 Обобщающие значения политропного процесса.
- •§9 Пример исследования политропного процесса.
Тепловое взаимодействие
При выводе уравнения dl =pdυ, удельный объем v играет роль механической координаты системы, а давление p – роль механической движущей силы. Отсюда следует правило: количество взаимодействия системы со средой равно произведению движущей силы на изменение координаты системы.
При нахождении количества теплового взаимодействия необходимо знать, какая физическая величина играет роль тепловой движущей силы и тепловой координаты системы. При тепловом взаимодействии роль тепловой движущей силы играет Т, а роль тепловой координаты – энтропия s [Дж/кг·К]
Количество теплоты подводимой(отводимой) за конечный процесс:
q=∫12dq=∫12Tds
Чтобы взять интеграл ∫12Tds, необходимо знать зависимость T=f(s). =>
q=∫12dq=∫12Tds=∫12f(s)ds
Зависимость вида T=f(s) графически изображается в системе координат, в которой по оси абсцисс откладывается энтропия, а по оси ординат Т. Пусть точка 1 характеризует начальное состояние газа в T-s координатах. Эта точка соответствует точке 1 в p-V координатах, (т.к. зная p1и υ1 по уравнению состояния pυ =RT определим T1; а зная зависимость T=f(s) можем определить S1.)
Определим на графике элементарное количество теплоты dq=Tds.
Ссумируя элементарные площадки ds, получим площадь под кривой процесса в T-s-координатах. Она равна теплоте, подводимой (отводимой) к газу за процесс. Диаграмма T-s, в которой площадь под кривой процесса численно равна теплоте, подводимой или отводимой от газа за процесс, называется тепловой диаграммой.
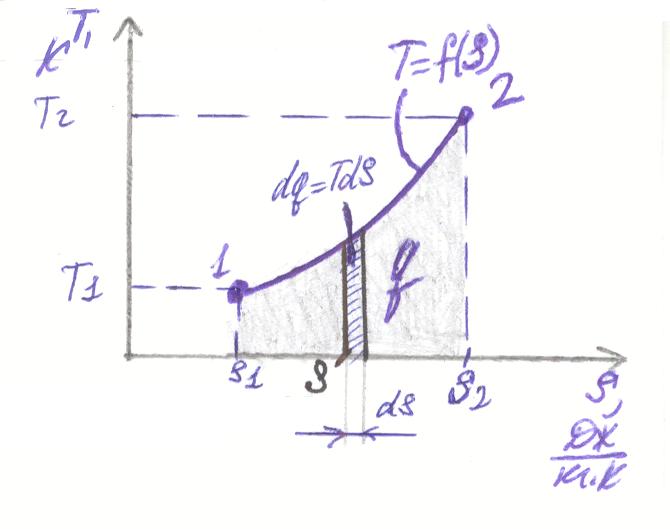
Особенности тепловой диаграммы:
Дает наглядное представление
2) Площадь под кривой процесса определяет теплоту, подводимую к газу за процесс.
а) Если ds>0 (энтропия растет), а Т>0 всегда, то dq>0 (q>0).
б) ds<0, dq<0 (q<0).
в) ds=0, dq=0 (q=0).
3) Количество подводимой теплоты является функцией процесса, т.к. ее величина зависит от вида процесса.
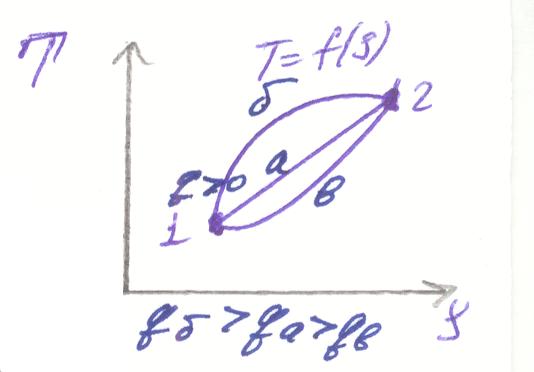
При рассмотрении рабочей и тепловой диаграммы видно, что работа и теплота- функции процесса, а внутренняя энергия- функция состояния.
lб > lа > lв
qб > qа > qв
q = Δu + l
Δu б = Δu а = Δu в
§5 Теплоемкость идеального газа.
Удельной теплоемкостью вещества (газа) называется количество теплоты, которое необходимо подвести или отвести от 1 кг газа, чтобы изменить температуру на 1 К.
с=dq/dT=Дж/(кг ∙К)
Теплоемкость реальных газов зависит от температуры и растет с увеличением температуры:
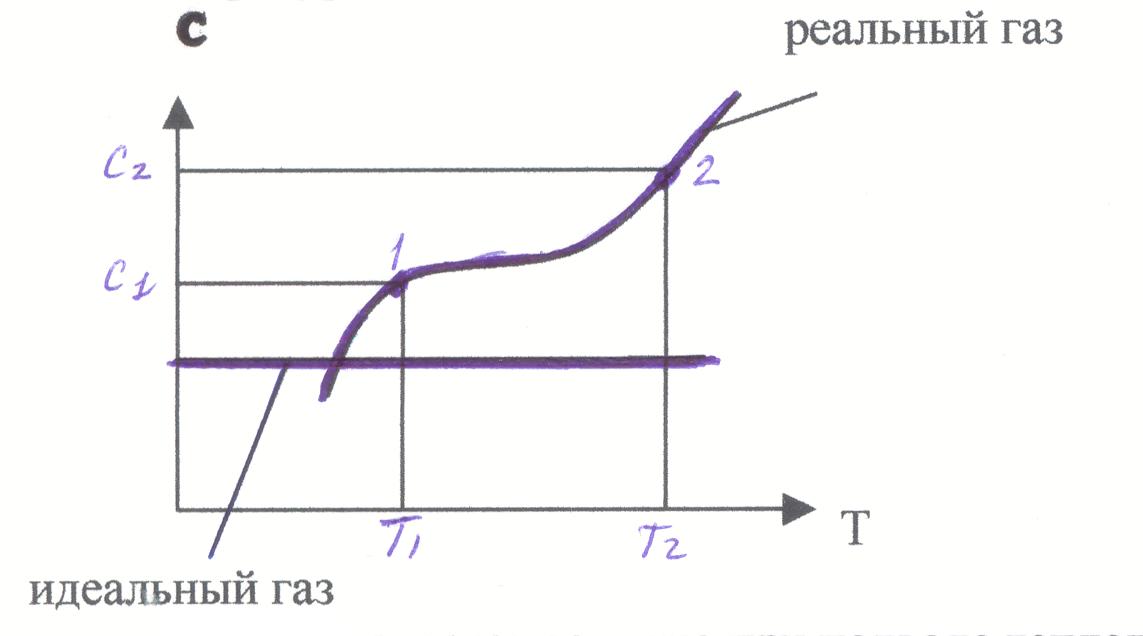
Это объясняется тем, что при подводе теплоты к реальным газам изменяется не только кинетическая энергия молекул, но и повышается интенсивность внутримолекулярного движения, причем с повышением температуры доля теплоты, затраченная на повышение интенсивности внутримолекулярного движения растет.
Идеальный газ состоит из неделимых молекул и поэтому в идеальном газе теплоемкость не зависит от температуры.
Теплоемкость газа при данной температуре называется истинной теплоемкостью.
![]()
dq=cdT
q=∫12 cdT
Чтобы взять этот интеграл, необходимо знать зависимость c=f(T). =>
q=∫12 cdT=∫12f(T)dT.
На практике вводится понятие средней теплоемкости:
Cm=a+bTcp, где а и b- справочные величины, а Тср=(Т1+Т2)/2
В зависимости от единицы измерения теплоемкости различаются:
а) массовая с =Дж/кгК;- для 1 кг газа
б) объемная с’=Дж/м3 К;- 1 м3 газа
в) мольная μс=Дж/моль К;- 1 моля
Связь между теплоемкостями: (с) = (μс)/μ = (с’)v
Теплоемкость идеального газа не зависит от температуры, но является функцией процесса. Это объясняется тем, что в соответствии с 1 законом термодинамики, в различных процессах происходит разное перераспределение подводимой теплоты между изменением внутренней энергии и совершением работы.
Рассмотрим пример: рассмотрим два цилиндра.
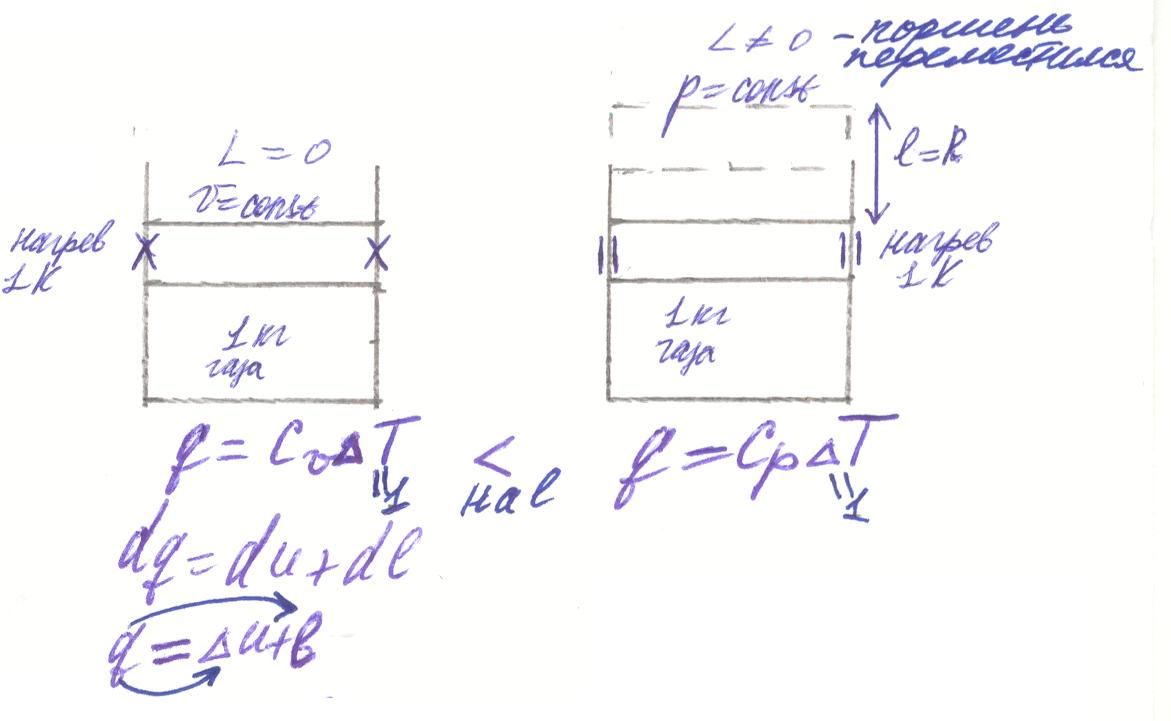
В обоих процессах изменение внутренней энергии ∆u – одинакова, а работа совершается разная. В процессе при v=const работа не совершается.
Будем обозначать теплоемкость газа в данном процессе сn:
dq= сn dT
q = ∫12 сn dT= сn(T2-T1)
Индекс n указывает на ход процесса, на его характер.
Таким образом теплота идеального газа не зависит от температуры и является функцией процесса.
q= сn(T2-T1)
