
- •Конспект лекцій з курсу
- •7.05060104, 8.05060104 Технологія теплоносіїв та палива на теплових електростанціях
- •Введення. Програма курсу. Основні розділи. Література.
- •Порівняння іонного обміну та зворотного осмосу:
- •Розділ 1. Теоретичні основи та застосування сорбційних та мембранних процесів на електростанціях
- •1.1. Загальні поняття про сорбцію та сорбційні процеси.
- •Чому робоча ємність завжди нижча за повну?
- •Екстракція
- •Осадкоутворення
- •1.2. Механізм сорбції.
- •1) Іони дифузійного шару біля поверхні 2) іони дифузійного шару всередині рідини
- •1.3 Закономірності протікання сорбційних процесів
- •1.4 Концентраційний фронт та вихідна крива як характеристики сорбційного процесу
- •1.5 Сорбційні апарати. Класифікація та принципи функціонування
- •Розділ 2. Фізико-хімічні основи іонного обміну. Сучасні іонообмінні матеріали (іоніти), які використовуються у водопідготовці
- •2.1. Загальні поняття про іонний обмін та іоніти
- •2.2 Типи іонітів
- •2.3 Реакції і/о з врахуванням типу іоніту
- •2.4 Фізико-хімічні і технологічні властивості іонітів.
- •2.5. Промислове використання іонітів. Екологічний аспект і/о
- •2.6 Проблеми експлуатації та очищення забруднених іонітів
- •2.7 Основні вимоги до іонітів на аес, особливості експлуатації та знешкодження
- •Розділ 3. Основи мембранних процесів
1.2. Механізм сорбції.
Сорбційні процеси є основою ряду технологічних процесів: і/обм. очищення води (РТ), деаерація (ГР), декарбонізація (ГТ), рекарбонізація (РГ), винесення речовини з пари (ГТ), тощо. З численних варіантів апаратно-технологічного оформлення в умовах ЕС сорбційні процеси частіше реалізуються в умовах спрямованого переміщення фаз щодо одна одної (динамічне пропускання обробляємої рідкої суміші (розчину) крізь нерухомий шар твердої фази (сорбент).
Частка твердої фази, на якій відбулася адсорбція іонів з розчину
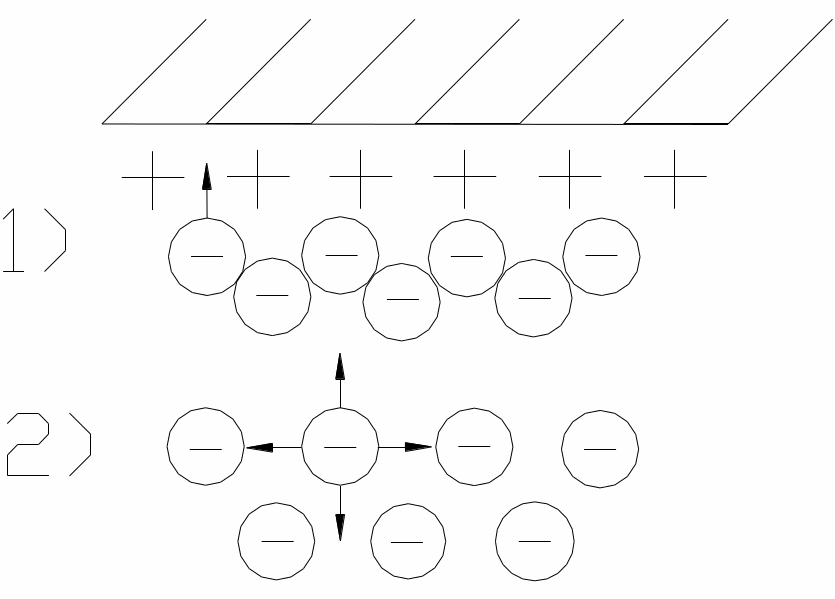
1) Іони дифузійного шару біля поверхні 2) іони дифузійного шару всередині рідини
Для цих умов схематично механізм сорбції часток з розчину електроліту можна розглянути як адсорбцію окремих іонів, що відбувається на межі розподілу «розчин - поверхня твердої фази». Важливою та необхідною характеристикою є здатність обох фаз до дисоціації (тобто розкладання на іони).
Просторово процес взаємодії починається з контакту двох фаз та молекулярної або хімічної взаємодії на межі поділу фаз. Атоми, молекули або іони, які знаходяться на межі, завдяки ненасиченості їх міжмолекулярних або хімічних зв'язків мають підвищену активність. При адсорбції іонів одного знаку, поверхня приймає заряд цих іонів, а розчин біля неї - протилежний за знаком внаслідок надлишку іонів, протилежних за знаком сорбованим іонам. Це створює різницю потенціалів між розчином і поверхнею і, як наслідок, обумовлює тяжіння поверхнею іонів протилежного знаку заряду з розчину.
При цьому на іони, що знаходяться в розчині, діють такі сили:
1) сила електростатичного тяжіння з боку твердої фази,
2) дифузійні сили, під дією яких ці іони можуть рівномірно розподілятися по всьому об'ємі розчину.
Дія цих сил призводить до утворення навколо твердої фази дифузійного шару іонів або іонної атмосфери, в якому концентрація іонів закономірно зменшується з віддаленням від поверхні твердої фази до меж розчину.
Іони дифузійного шару, що мають запас кінетичної енергії, можуть вириватися з іонної атмосфери і переходити в розчин, з якого у свою чергу внаслідок дифузії можуть надходити іони того ж знаку заряду в еквівалентних кількостях (зберігання принципу електронейтральності).
Процес взаємодії фаз гетерогенної системи закінчується встановленням певного рівноважного розподілення обмінних іонів між фазами.
Висновок. З вищенаведеного, механізм процесу адсорбції можна характеризувати трьома складовими моментами:
виникнення заряду в твердій фазі внаслідок появи на ній потенціалутворюючих іонів. Потенціалутворюючі іони з'являються на поверхні внаслідок процесу дисоціації полярних молекул твердої фази, н-д, під дією води і кріпляться до так званої матриці сорбенту
утворення іонної атмосфери з протилежно заряджених іонів біля твердої фази
заміна іонів, які утворюють іонну атмосферу, іонами того ж знаку з розчину.
Іони, сорбовані поверхнею (на мал. +) називають потенціалутворюючими (фіксованими або анкерними іонами); іони, що утворюють іонну атмосферу (на мал. -) називають іонами дифузійного шару.
В зв'язку з тим, що іони дифузійного шару протилежні за знаком фіксованим іонам, їх зазвичай називають протиіонами (-); іони в розчині, однойменні з зарядом фіксованих іонів називають коіонами (+).
В залежності від характеру появи потенціалутворюючих іонів на поверхні твердої фази, при внесенні її в розчин м.б. різний ефект.
1) Спочатку тверду фазу, яка здатна адсорбувати потенціалутворюючі іони (+) вносять в розчин з + та – іонами. Процес адсорбції потенціалутворюючих іонів R+H+=(RH)+. Позитивно заряджена тверда фаза з + іонами буде притягувати – іони дифузійного шару (RH)++Cl-=(RH+/Cl-). Як наслідок – зменшення концентрації Н та Cl в розчині – молекулярна адсорбція. При наявності в розчині інших аніонів внаслідок дифузії відбудеться заміна.
2) Якщо в розчин електроліту внести тверду фазу, яка дисоціює з віддачею іонів тільки одного знаку заряду, в перший момент буде спостерігатись утворення іонної атмосфери з цих дисоціюючих іонів. Внаслідок дифузії відбудеться заміщення іонів дифузійного шару іонами з розчину. Н-д, тверда фаза – важкорозчинна кислота і при внесенні її в розчин утворюється дифузійний шар іонів Н+. Якщо катіони в розчині Na, то вони замістять іони Н.
У водопідготовці виключне застосування мають саме процеси заміщення іонів дифузійного шару твердої фази іонами з розчину – прийнято називати такий процес сорбцією (а не молекулярною адсорбцією).
Для процесу сорбції іонів з розчину в сорбент можна виділити та практично спостерігати три стадії:
доставка витиснювальних іонів з розчину на поверхню сорбенту
проникнення витиснювальних іонів всередину сорбенту
хімічна взаємодія іонів розчину з іонами сорбенту.
Іноді говорять про 4 та 5 стадії:
пересування витисняємого іону з середини від точки обміну до поверхні сорбенту
переміщення витісняємого іону від поверхні сорбенту в розчин.
Всі стадії протікають послідовно, з різними швидкостями та одночасно в різних місцях сорбенту.
Звертає увагу, що стадії 1 і 5, 2 і 4 є одно типовими (дифузійні), тобто передають різноманітне по напрямку, але не за характером пересування іонів, тому іноді обмежуються описом перших або останніх трьох стадій.
1-3 – робочий процес, 4-5 – регенерація.
