- •Конспект лекцій з курсу
- •7.05060104, 8.05060104 Технологія теплоносіїв та палива на теплових електростанціях
- •Введення. Програма курсу. Основні розділи. Література.
- •Порівняння іонного обміну та зворотного осмосу:
- •Розділ 1. Теоретичні основи та застосування сорбційних та мембранних процесів на електростанціях
- •1.1. Загальні поняття про сорбцію та сорбційні процеси.
- •Чому робоча ємність завжди нижча за повну?
- •Екстракція
- •Осадкоутворення
- •1.2. Механізм сорбції.
- •1) Іони дифузійного шару біля поверхні 2) іони дифузійного шару всередині рідини
- •1.3 Закономірності протікання сорбційних процесів
- •1.4 Концентраційний фронт та вихідна крива як характеристики сорбційного процесу
- •1.5 Сорбційні апарати. Класифікація та принципи функціонування
- •Розділ 2. Фізико-хімічні основи іонного обміну. Сучасні іонообмінні матеріали (іоніти), які використовуються у водопідготовці
- •2.1. Загальні поняття про іонний обмін та іоніти
- •2.2 Типи іонітів
- •2.3 Реакції і/о з врахуванням типу іоніту
- •2.4 Фізико-хімічні і технологічні властивості іонітів.
- •2.5. Промислове використання іонітів. Екологічний аспект і/о
- •2.6 Проблеми експлуатації та очищення забруднених іонітів
- •2.7 Основні вимоги до іонітів на аес, особливості експлуатації та знешкодження
- •Розділ 3. Основи мембранних процесів
Розділ 1. Теоретичні основи та застосування сорбційних та мембранних процесів на електростанціях
1.1. Загальні поняття про сорбцію та сорбційні процеси.
Визначення сорбції та сорбційного процесу, умови проведення
Термін «сорбція» (від латин. Sorbeo - поглинаю) означає поглинання твердим тілом або рідиною речовини з навколишнього середовища. Біосорбція – активне вугілля дозовано вносять в аеротенк з активним мулом або в одношарових біосорберах.
Сорбційний процес - самодовільний перерозподіл окремих компонентів між фазами, який йде без глибоких хімічних перетворень у двохфазних гетерогенних системах ГТ, ГР, РТ, РР (особливі властивості обох фаз). Розглядається як окремий випадок процесів перерозподілу з допоміжною активною фазою, внесену в рідину (або газ) для часткового або повного розділення компонентів.
Внаслідок сорбційного процесу склад фаз змінюється - вони збагачуються одними й збіднюються іншими компонентами в певній мірі - звичайний випадок гетерогенного обміну та рівноваги. Оскільки ці компоненти розподілені в різній степені між фазами гетерогенної системи, то сорбційні процеси протікають в кожній фазі: в одній їх кількість збільшується, в іншій - зменшується.
Н-д, на початку досліду є: дві фази (сорбент та розчин), які містять різні іони (розчин – іони виду i, сорбент – іони виду j). Знак заряду іонів повинен бути однаковим. При їх контакті починається взаємодія та взаємний перехід іонів, який продовжується до стану рівноваги:
Перебіг і характер взаємодії фаз системи, а отже, характер і перебіг сорбційних процесів залежать від агрегатного стану фаз, властивостей і складу всіх компонентів, умов їхньої взаємодії, часу контакту. Часто одна з фаз практично не розчинна в іншій, компоненти ж останньої можуть поглинатися першою; також фізичний стан (суцільність, диспергованість) кожної фази м.б. різним (розчин – рідина, сорбент – шари з окремих часток).
Наочно закономірності сорбційного процесу можна простежити в такому досліді: колонки заповнюють шарами сорбенту різної довжини (Х1, Х2, Х3), починають пропускати розчин з відомою концентрацією компоненту та виміряють час, на протязі якого сорбент буде повністю поглинати цей компонент (об'єм розчинів однаковий для всіх колонок). Відклавши по осі абсцис довжину шарів Хі (причому Х1<Х2<Х3), а по осі ординат час роботи шару сорбенту t (відповідно t1<t2<t3) - отримують графік. Зі збільшенням товщини шару сорбенту час роботи сорбенту збільшується.
Нелінійна ділянка (ОА) на початку викликана неоднорідністю сорбенту, пов'язана з формуванням працюючої зони сорбенту, перед паралельним перенесенням речовини вздовж шару (ділянка АВ).
V1=V2=V3
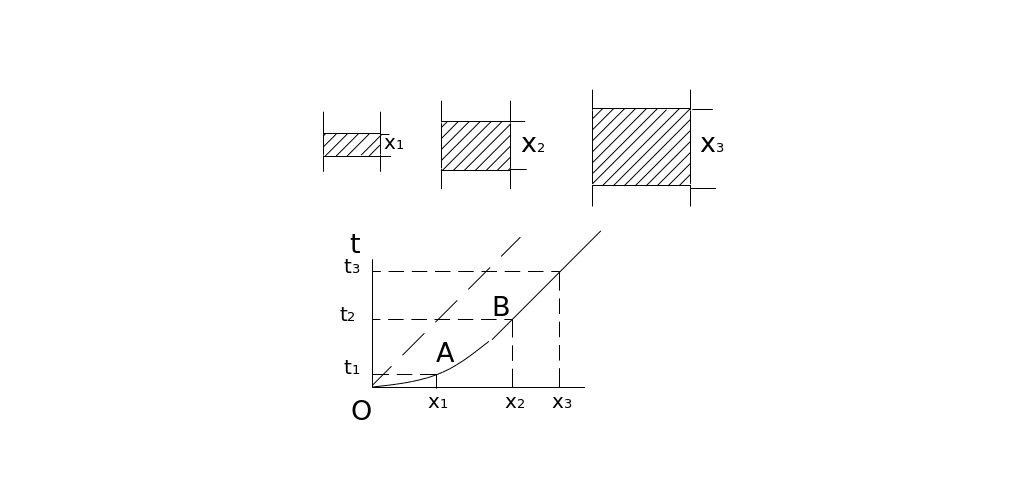
Протікання сорбційного процесу
Якщо процес перерозподілу компонентів йде зі зменшенням кількості цільового компоненту в менш щільній фазі, то його називають сорбцією; в протилежному випадку процес називають десорбцією (регенерацією).
Н-д, з розчину (1 фаза) сорбується іон Н+, десорбується з фази сорбенту (фаза 2) іон Na+. |
|
Схема сорбції-десорбції
Речовина, що сорбується, називається сорбатом (найчастіше це іони чи молекули з розчину). Сорбат повинен бути електролітом, тобто здатним розкладатись на іони. Частіше розглядаються процеси коли сорбат – розчин (природна вода, розчин електролітів).
Фазу, що поглинає компоненти із сусідньої фази, тобто більш щільна речовина, що бере участь у процесі перерозподілу, називають сорбентом.
Сорбенти - тверді, зернисті або волокнисті, механічно тривкі, нерозчинні та хімічно стійкі речовини, які використовують для видалення або розділення компонентів. Неодмінною властивістю сорбентів є їх спроможність утримувати на своїй поверхні або всередині різноманітні іони і при певних умовах обмінювати їх на інші іони з розчину, який контактує з сорбентом в сорбційному процесі (сульфовугілля, силікагель, іоніти).
Найважливіші характеристики сорбентів: гранулометричний склад та сорбційна ємність.
1) сорбенти бувають різні за формою, невеликі за розмірами (найчастіше гранули* Ø до 5мм)
*гранулами називають яскраві зерна
2) кількість іонів в сорбенті, які здатні до обміну, становить величину сорбційної або обмінної ємності (аналогія з концентрацією в розчині – визначається прямим титруванням. В сорбенті сорбційну ємність легше розраховувати за зміною концентрації розчину). Іони з сорбенту повинні проявитись – вступити в реакцію.
Розрізняють поняття сорбційної ємності сорбенту (еквівалентна кількість компоненту, яку здатен поглинути певний об'єм сорбенту з розчину, н-д, мг-екв/мл) та сорбційної ємності шару сорбенту (мг-екв/мл*мл сорбенту=мг-екв). Вони відрізняються: перша величина визначається лише типом та природою сорбенту, а друга – умовами праці шару (швидкості пропускання розчину, його концентрацією тощо).
Сорбційну ємність розрізняють також з технологічної точки зору:
робоча або до проскоку - кількість компоненту, поглинутого сорбентом до появи певної, заданої кількості (проскоку) компоненту в фільтраті. Графічно відповідає площі ОАBD – визначається величиною проскоку, тобто ординатою точки В. Є величиною питомою, інтегральною, залежить від регенерації (1200 - 120 кг солі, 1400 – 140 кг).
повна або до виснаження – кількість цільового компоненту, поглинутого при повному виснаженні сорбенту, тобто при вирівнюванні концентрації компоненту у фільтраті з вихідною. Графічно – площа OABE – постійна величина для кожного сорбенту. Не залежить від концентрації та природи, тобто здатності до сорбції, будь-яких іонів.
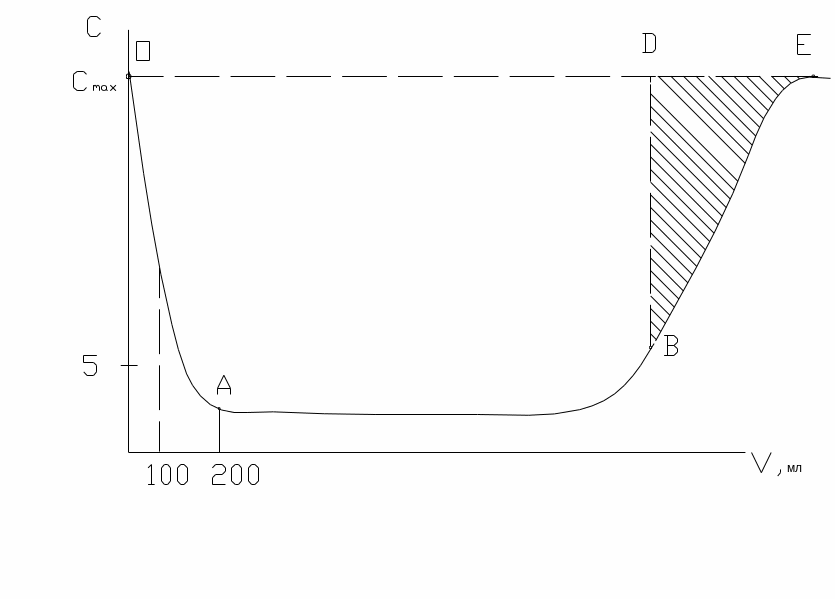
Графічне представлення вихідної кривої