
- •Конспект лекцій з курсу
- •7.05060104, 8.05060104 Технологія теплоносіїв та палива на теплових електростанціях
- •Введення. Програма курсу. Основні розділи. Література.
- •Порівняння іонного обміну та зворотного осмосу:
- •Розділ 1. Теоретичні основи та застосування сорбційних та мембранних процесів на електростанціях
- •1.1. Загальні поняття про сорбцію та сорбційні процеси.
- •Чому робоча ємність завжди нижча за повну?
- •Екстракція
- •Осадкоутворення
- •1.2. Механізм сорбції.
- •1) Іони дифузійного шару біля поверхні 2) іони дифузійного шару всередині рідини
- •1.3 Закономірності протікання сорбційних процесів
- •1.4 Концентраційний фронт та вихідна крива як характеристики сорбційного процесу
- •1.5 Сорбційні апарати. Класифікація та принципи функціонування
- •Розділ 2. Фізико-хімічні основи іонного обміну. Сучасні іонообмінні матеріали (іоніти), які використовуються у водопідготовці
- •2.1. Загальні поняття про іонний обмін та іоніти
- •2.2 Типи іонітів
- •2.3 Реакції і/о з врахуванням типу іоніту
- •2.4 Фізико-хімічні і технологічні властивості іонітів.
- •2.5. Промислове використання іонітів. Екологічний аспект і/о
- •2.6 Проблеми експлуатації та очищення забруднених іонітів
- •2.7 Основні вимоги до іонітів на аес, особливості експлуатації та знешкодження
- •Розділ 3. Основи мембранних процесів
2.4 Фізико-хімічні і технологічні властивості іонітів.
Технологічні якості іонітів в значній мірі залежать від вихідної сировини, засобу виготовлення, природи обмінних іонів і умов практичного застосування. Технологія їх виготовлення складна, відступи від прийнятого засобу неминуче спричиняють отриманню іонітів нестандартної якості. Будучи споживачем іонітів і не маючи можливості впливати на якість промислових зразків, технологи ВПУ повинні контролювати якість кожної нової партії – це необхідно для правильного вибору й економічного й ефективного режиму їх використання. Для однакової оцінки якості іонітів, методи визначення показників уніфікуються у вигляді відповідності Держстандартам, методикам визначення певних властивостей.
Якість іонітів визначається фізико-механічними, хімічними і технологічними властивостями.
Фізико-механічні властивості.
1. Фізична форма іонітів - грає істотну роль, тому що від цього залежать умови зіткнення розчину електроліту з іонітом. Промислові та експериментальні зразки виготовляються переважно у вигляді сферичних гранул або зерен неправильної форми, існують порошкоподібні іоніти і композиції у вигляді і/обм. мембран (еластичні листи), і/обм. волокна, рідкі іоніти.
Сферична форма переважна, тому що: забезпечується найменший опір шару іоніту потоку води, зменшуються втрати іоніту, полегшується здійснення протиточних технологій.
2. Фракційний (гранулометричний) склад. Різноманітні фізичні і хімічні властивості зернистих іонітів, а також параметри процесів за їх участю багато в чому залежать від розмірів їхніх часток. Розмір часток впливає на перепад тиску у фільтрах і для ФЗД на повноту гідравлічного поділу шихти. За інших рівних умов із зменшенням розміру часток перепад тиску в шарі, що фільтрує, збільшується. Розміри і форма зерен також впливають на ступінь використання обмінної ємності в статичних і динамічних умовах і на розширення шару при розпушенні. На практиці важливо тому, щоб по цьому показнику іоніти відрізнялися max однорідністю, тобто найбільше кращі зерна правильної форми (особливо сферичної), що забезпечують однорідне упаковування шару і найкращі кінетичні умови процесу (max обсяг при min поверхні). З досвіду промислових і/обм. процесів відомо, що оптимальними є однорідні іоніти із середнім розміром зерен 0,5-0,7 мм. Для промислового застосування розмір часток є компромісом між швидкістю реакції обміну (яка більше з малими зернами) і вищою швидкістю потоку (яка потребує великих часток для зменшення втрат).
В зв'язку з тим, що в промислових умовах синтезувати однорідні іоніти неможливо, їх попередньо фракціонують. У відповідності зі стандартними вимогами 92-95 % набухших зерен або сферичних гранул полімеризаційного типу повинна складати фракція 0,3-1,2 мм із середнім розміром зерен 0,5-0,6 мм, для поліконденсаційних іонітів - фракція 0,4-2,0 мм із середнім розміром 0,7-0,8 мм (для сферичних гранул цей показник - діаметр; для зерен неправильної форми - середній розмір поперечника зерна).
Сферична форма зерен іоніту сприяє їх рівномірному розташуванню в іонообмінній колонці, чим забезпечується сприятливе розподілення рідини по перерізу фільтру.
Фракційний склад звичайно визначається методом сухого або мокрого розсіву за допомогою набору сит з різними діаметрами комірок або оглядом під мікроскопом.
1 г звичайного іоніту містить близько 3700 зерен
Куля:
повна площа поверхні
![]() ,
об'єм
,
об'єм
![]()
Порошкоподібні іоніти мають розмір від 0,04 до 0,07 мм, композиції у вигляді і/обм. мембран (еластичні листи товщиною 0,1-1 мм).
3. Насипна маса і насипний об'єм. Насипною масою називають масу одиниці його обсягу, виражену в г/см3 або т/м3. Розрізняють значення насипної маси в сухому або вологому стані. Під насипною масою вологого іоніту розуміють вагу 1 м3 вологого іоніту після висушування його до повітряно-сухого стану, виражену в тонах. Може бути визначена діленням насипної маси повітряно-сухого іоніту на коефіцієнт набухання (Кнаб. - відношення насипної маси іоніту у сухому стані до насипної маси іоніту у пологому стані).
![]() ,
г/см3
,
г/см3
![]()
Значення насипної маси іоніту mн в повітряно-сухому стані - для визначення розмірів складу для збереження. Значення mн у вологому стані - важливе для визначення розмірів і числа іонітних фільтрів.
Насипний
об'єм -
величина, обернена насипній масі:
![]() см3/г
см3/г
Для катіонітів значення насипної маси - 0,5-0,9 г/см3; для аніонітів - 0,3-0,8 г/см3.
Питома вага – відношення ваги тіла до об'єму тіла [Н/м3]
Питомий об'єм – відношення об'єму який займає речовина до його маси [м3/кг]
4. Важливий технологічний показник – вологість. В силу гідрофільності функціональних груп волога, що утримується в іоніті, є «хімічно зв'язаною», причому спеціальне видалення цієї вологи призведе надалі при експлуатації тільки до фізичної руйнації гранул. Зовнішня волога, не пов'язана хімічно з функціональними групами, перед упаковкою може бути видалена центрифугуванням або фільтруванням. Оптимальне утримання вологи в іоніті є поступкою між кінетичними характеристиками іоніту і загальної кількості введених функціональних груп.
Для зручності транспортування, іонообмінні смоли упаковують по стандартній вазі, і продають їх певними об'ємами - вже для зручності споживача. Для кожного продукту визначається і постійно коректується насипна вага вологого продукту, яка дорівнює відношенню ваги до об'єму (кг/м3).
Вологість іоніту W виражається в % і визначається висушуванням та зважуванням, має значення при розрахунках закупки іонітів, тому що вартість останнього встановлюється за тонну матеріалу визначеної (стандартної) вологості.
Чисельні значення вологості для катіонітів 35-60 %, аніонітів - 50-70 %.
З врахування вологості та насипної маси можна розрахувати кількість сухого іоніту:
![]() ,
г.
,
г.
Вологість залежить від пористості іоніту:
висока вологість:
|
низька вологість:
|
У макропористих іонітів два види вологість: гелева фаза та макропори |
У гелевих іонітів висока вологість призводить до зниження зшитості, крихкості, окислюваності, полегшення регенерації |
5. Щільність іонітів – відношення маси речовини до об'єму [кг/м3] у залежності від іонної форми і природи складає 1,05-1,55 г/см3. Щільність аніонітів при цьому нижча, ніж у катіонітів, що лежить в основі гідравлічного поділу їхніх сумішей. Шляхом підбору іонітів підхожої щільності, декілька їхніх різноманітних типів можуть бути в однім фільтрі (ФЗД) і розділятися висхідним потоком води. Щільність набухшого іоніту завжди більше 1 і менше щільності сухого іоніту.
Тип іоніту |
Щільність, г/см3 (типові) |
Сильнокислотні катіоніти |
1.17 - 1.38 (1.28) |
Слабкокислі катіоніти |
1.13 - 1.20(1.17) |
Сильноосновні аніоніти |
1.07 - 1.12 (1.09) |
Слабкоосновні аніоніти |
1.02 - 1.10 (1.04) |
Щільність (істинна волога щільність гранул) важлива для розділення ФЗД, фільтрів з двошаровим завантаженням, ожиженим шарам, спушування.
Вимірювання – пікнометричне.
6. Механічна тривкість - визначає можливість використання іонітів у конкретних умовах, терміни їхньої служби, і, отже, економічну ефективність. Механічна тривкість сприяє спроможність до опору при різноманітних деформаціях, тому що при експлуатації іоніти піддаються механічним навантаженням (здавлюванню, тертю); уникнути співудару зерен між собою, зі стінками фільтрів, їхнього відносного переміщення неможливо. Мірою механічної тривкості сипучих іонітів служать дані про зміну фракційного складу після експлуатації, що задається через коефіцієнт зтираємости, визначаємий як втрата маси в % за рік. Механічно тривкими прийнято вважати такі, відсоток зтираємости яких не перевищує 0,5 % за рік. Для швидкого аналізу - розмел у млині з і без сталевими або агатовими кулями.
7. Термічна стійкість
У водних розчинах термічному руйнуванню підлягають полярні зв'язки функціональних груп – внаслідок чого втрачаються іонообмінні властивості.
В процесі деградації аніонітів знижується основність: моно функціональний високоосновний стає поліфункцоінальним середньоосновним, потім – слабкоосновним.
Реакції термічного розкладання
Сульфокатіоніти: відщеплення сульфогруп:
|
Карбоксильний катіоніт
|
Катіоніти більше термостійкі ніж аніоніти, солеві форми більш стійкі ніж воднева та гідроксильна форми (різниця температур початку розкладання до 50 оС).
Вплив температури на іоніти
Заморожування: |
Нагрівання: |
|
нема помітного ефекту при зниженні температури до – 40 оС. Для відновлення треба дати відтаяти при 12...25 оС |
катіоніти витримують температуру до 100 оС (треба стерегтися окислювачів та важких металів) |
|
аніоніти чутливі до нагрівання |
||
- ВОА тип 1 |
до 60 оС |
|
- ВОА 2 типу та акрилові |
до 35 оС |
|
- НОА (стирольні та акрилові) |
до 60 оС |
|
Для порошкоподібних (нерегенеруємих) іонітів – допускаються підвищені температури.
-
Тип фільтру
Тип іоніту
Допустима температура, оС
Насипний
Сульфокатіоніти
80-90 (іноді до 120)
Аніоніти
35-50
Намивний
Сульфокатіоніти
120-130
Аніоніти
100-110
Іоніти характеризуються електризуємістю, тому що спроможні накопичувати заряди статичної електрики при терті, що ускладнює експлуатацію (злипання зерен, прилипання до стінок апаратів.) Для попередження електризуємості, іоніти оброблюють речовинами, що підвищують їхню електропровідність? Також відомо, що в абсолютно сухому стані іоніти мають високий електричний опір. При набряканні в полярних розчинниках шар набухшого іоніту стає достатньо електропровідним. У звичайних умовах електропровідність шарів цілком набухших у воді зерен іонітів коливається в межах 0,001-0,1 Ом-1*см-1, що використовується для електрохімічної регенерації.
Основні хімічні властивості.
1. Хімічну стійкість промислових іонітів оцінюють насамперед по їхній розчинності у воді і розчинах, реагентах, які використовуються для регенерації і виражається в їх спроможності протистояти розчинюючій дії води та її домішок.
Залежить стійкість від складу іоніту і його структури, рН середовища, кількості функціональних груп.
Як правило іоніти більш схильні до пептизації (переходу в колоїдний розчин) при насиченні одновалентними іонами (H, Na, OH), а також при малій концентрації електролітів у воді, ніж при насиченні багатовалентними іонами (Ca, Mg, SO4) або в концентрованих розчинах солей.
Окислювачі – кисень, хлор, озон, перекис водню руйнують іоніти, залізо та інші важкі метали в таких окислювальних процесах є каталізаторами. Внаслідок окислення сітка полімеру руйнується.
Стійкість іонітів визначається індивідуально, але, як правило, і катіоніти і аніоніти більш стійкі в кислому середовищі, ніж у лужному. Вважається також, що полімеризаційні іоніти, особливо солеві форми, найбільш стійкі. Стійкість залежить і від температури, у зв'язку з чим не рекомендується підвищувати Т на і/обм. фільтрах більше 313 К (40 оС), тому що стійкість знижується при підвищенні Т. Нагрів іонітів призводить до зміни їхніх структури і хімічного складу, зводиться до відщіплення функціональних груп і руйнації полімерного каркасу. Солеві форми, як правило, більш стійкі, ніж Н и ОН (початок розкладання складає ~50 °С). Заморожування вологих іонітів у більшості випадків не призводить до помітної втрати обмінної ємності, але обумовлює їх механічну руйнацію (здрібнювання).
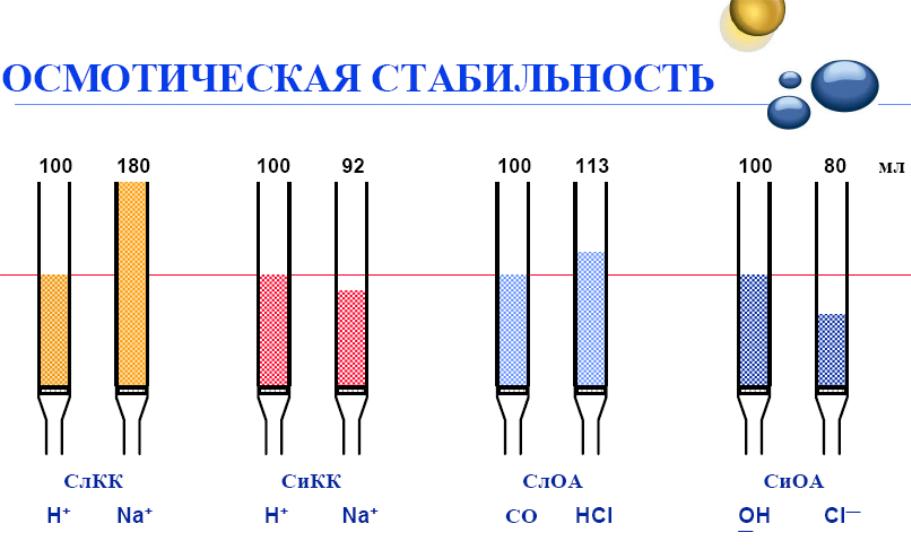
2. Осмотична стабільність(ОС) - один із найважливіших показників – характеризує здатність іоніту зберігати цілісність зерен внаслідок багатократного переходу з кислої (для катіонітів) або основної (для аніонітів) форми в солеву та навпаки. Поперемінне розтягування і стискання полімеру при наявності дефектів у його структурі супроводжується розривами ланцюгів у місцях max напруги. Мікроскопічні розриви згодом перетворюються в тріщини і, зрештою, призводять до самодовільного розтріскування зерен.
Іншими словами, у процесі і/о конфігурація іонів навколо кожної активної групи змінюється, адсорбований (поглинений) іон, як правило, має інший розмір і інший рівень дегідратації, чим заміщаємий іон. Зерно іоніту, отже, може помітно набухати або стискатися в ході реакції. Стреси, до яких схильний іоніті в ході цих змін об'єму, відомі як осмотичні сили. Вони дуже інтенсивні і можуть робити локальні тиски в декілька тисяч кПа - набагато більше, ніж чисто механічний тиск. Іоніти для промислового використання повинні бути спроможні витримувати сотні циклів виснаження і регенерації. Стійкість до зміни змісту розчинника в різноманітних іонітів не однакова.
Дослідження іонітів на ОС проводять або за ГОСТ, що передбачає проведення 150 циклів опрацювання порції іоніту розчинами кислоти і лугу з проміжними промиваннями дистильованою водою і наступне визначення кількості не зруйнованих гранул у % від загальної кількості зерен до та після обробки.
Як правило, гелеві іоніти поступаються за ОС смолам макропористої і ?зернистої структури.
Для збільшення терміну служби іонітів необхідно уникати ситуацій, при яких можливі осмотичні удари (тобто швидке набухання). Значні руйнації спостерігаються у іонітів в сухому стані, які занурюють безпосередньо у воду (краще розчини 20-25 % NaCl); також не варто давати висихати іонітам, що відпускаються у вологому стані.
Більшість сучасних іонітів повинні мати високу ОС - 95 % і вище. Вимоги АЕС по цьому показнику також високі, залежать від місця використання іонітів і регламентуються відповідними документами.
Зменшення ОС спричиняє за собою такі негативні наслідки:
- зменшення стійкості іонітів до зміни об'єму в експлуатаційних циклах;
- зменшення терміну служби;
- зростає перепад тиску на фільтрі через дрібні частки;
- зменшується надійність експлуатації;
- погіршується якість оброблюваної води;
- зростаю експлуатаційні витрати.
3. Обмінна ємність(ОЄ) - також найважливіший показник для будь-якого іоніту, міра кількісної оцінки спроможності іоніту до реакцій подвійного обміну, що виражається числом еквівалентних іонів, обмінюванних 1 м3 іоніту. Так, наприклад, якщо ОЄ складає 500 г-екв/м3, то це означає, що 1 м3 такого іоніту обмінює 500 г-екв іонів, тобто може очистити від даного іону при його концентрації в розчині рівної 10 мг-екв/дм3 (10г-екв/м3) 50 м3 води, або при 5 мг-екв/дм3 - 100 м3 води тощо.
Розрахувати сумарну поверхню зерен іоніту, порівняти з розмірами та кількістю іонів в розчині
Встановлюють різницю між загальною (повною) ємністю і корисною (робочою) ємністю.
Повна обмінна ємність (ПОЄ) характеризує кількість в іонітах усіх іоногенних груп, незалежно від їхньої природи. Величина ПОЄ визначається за кількістю іоногенних груп в іоніті, є постійною характеристикою. Ще одне визначення ПОЄ - обмінна ємність, визначена в момент вирівнювання концентрації поглиненого іону у вихідній воді і фільтраті, відповідає max кількості іонів, вираженої в еквівалентних одиницях, що може сорбувати (обміняти) одиниця об'єму або маси іоніту.
Фільтрування води через шар іоніту може, в залежності від умов і режиму експлуатації фільтру, продовжуватись до моменту одержання певної концентрації іона, що поглинається, у фільтраті. Якщо фільтрування закінчується тільки з'явиться проскок іону, що поглинається, тобто при концентрації його близької до О, то використовується ОЄ до проскоку. За величину проскоку звичайно приймають величину порядку 0,01-0,05 мг-екв/дм3. Проте в експлуатації фільтрування часто припиняється в момент, коли залишкова концентрація іону, що поглинається, у фільтраті значно більша ніж величина проскоку, або зупиняють фільтр при припиненні поглинання одних іонів і проскакування інших. У таких випадках мова йде про робочу обмінну ємність іоніту (РОЄ). Враховується тільки та частина протиіонів, що використовується в даних виробничих умовах. Для кожного іоніту РОЄ не однозначна, залежить від зміни робочих умов і розмірів фільтрувального шару, від концентрації іонів, що видаляються і середнього розміру часток, швидкості фільтрування, температури, засобу і ступеня регенерації. Лабораторна обмінна ємність, яка визначається за допомогою лабораторних фільтрів, звичайно більше експлуатаційної ємності поглинання, визначеної на великих промислових фільтрах, в яких гідравлічні умови роботи шару звичайно менш сприятливі. Значення ОЄ невизначене, якщо не зазначені умови, у яких вони визначалися (мг-екв на масу висушеного або об'єм сухого або набухлого іоніту).
ПОЄ враховується для нового, РОЄ – для відрегенерованого іоніту.
У залежності від технічного прийому здійснення визначення ОЄ розрізняють статичну (СОЄ) і динамічну (ДОЄ) обмінні ємності. Величина СОЄ характеризується кількістю протиіонів, що вступили в обмін до моменту рівноваги, коли іоніт і розчин, що контактує, нерухомі. Будь-яка зміна умов такого статичного процесу призводить до нового значення СОЄ. При динамічному пропусканні розчину через шар іоніту кількість протиіонів, що вступають у реакцію, визначає величину ДОЄ й істотне значення має потік води, що обумовлює поступовий зсув рівноваги як в іоніті, так і в розчині. Абсолютне значення ОЄ при будь-якому засобі її вираження багато в чому залежить від обраної методики її визначення. Тому в даний час вибір засобів ОЄ регламентується відповідним стандартом (ГОСТ 20255).
Динамічною обмінною ємністю (ДОЄ) називають характеристику, подібну ПДОЄ, з тією лише різницею, що вимірюється не повна кількість іонів, поглинутих іонітом з розчину, а лише та, яка поглинута до першого проскоку поглинального іона у фільтрат. Цю характеристику іноді називають робочою обмінною місткістю (РОЄ).
Графічне уявлення про ОЄ іоніту. При фільтруванні розчину через фільтр при достатній висоті завантаження іоніту, практично відразу ж спостерігається падіння концентрації іону, який поглинається, на виході у фільтраті практично до О (АВ). Потім протягом деякого проміжку часу (ВР) концентрація практично не змінюється. Починаючи з моменту, обумовленого т.С, відбувається проскок сорбуємого іону у фільтрат.

Графічне уявлення про ПОЄ та РОЄ
Таким чином, можна констатувати, що геометрично SABCE, віднесена до одиниці об'єму іоніту відповідає проскоковій ОЄ. В міру пропускання нових порцій оброблюваної води, концентрація домішок у фільтраті буде збільшуватися і досягне значення, установленого регламентом експлуатації (т.Д). У виробничих умовах т..Д відповідає зупинці фільтру на регенерацію. Абсциса т.Д вказує об'єм очищеної води для даного технологічного циклу. SABCDF, віднесена до об'єму іоніту у фільтрі відповідає РОЄ. Якщо після досягання регламентованої концентрації домішки фільтр продовжує працювати, то в міру пропускання нових порцій розчину, концентрація сорбуємого іону буде зростати до повного вичерпання обмінних іонів іоніту і одержують ділянку кривої ДМ. Абсциса т.М відповідає загальному обсягу фільтрату, що пройшов очищення. Якщо далі пропускати через такий фільтр воду, то вона буде проходити його без змін в складі. SABCDMFE, віднесена до об'єму іоніту у фільтрі, відповідає ПОЄ іоніту.
ПОЄ<ОЄпр>РОЄ.
Н-д, ПОЄ для катіоніту:>3,9 мг-екв/г - суха смола, >1,2 мг-екв/см3 - волога смола.
РОЄ для аніоніту може бути оцінена як 3 кг органіки в 1м3 смоли за 1 цикл.
Вважається економічно оптимальними значення РОЄ=50-60 % ПОЄ.
ПОЄ і РОЄ є головними показниками і/обм. властивостей іонітів і мірою універсальності, тобто спроможності до сорбції будь-яких іонів. Їх необхідно відрізняти від сорбційної спроможності (ємності) тобто їхньої спроможності до виборчої сорбції іона в конкретних рівноважних умовах із складного розчину.
Перерахунок:
Е' = 1000 * Е * * (1-)
мг-екв/дм3 см3 в дм3 мг-екв/г г/см3 -порозність
Якщо концентрація різних іонів не однакова, то згідно ЗДМ поглинаються іони, які присутні в найбільшій концентрації, н-д, іони Са та Mg обмінюються на Na з концентрованих розчинів повареної солі.
Корисна обмінна ємність залежить від наступних факторів:
якості іоніту
розміру зерен
природи оброблюваного розчину (вихідної води), наявності заліза, марганцю, органіки, значення рН, швидкості його потоку, температури
питомого навантаження
товщини шару іоніту, площі фільтрування
природи та концентрації регенераційного розчину
системи регенерації (прямоточна чи протиточна)
Тип катіоніту |
ОЄ |
Тип аніоніту |
ОЄ |
||
г-екв/кг |
г-екв/дм3 |
г-екв/кг |
г-екв/дм3 |
||
Сильнокислотний гелевий |
4,5 |
2,05 |
Високоосновний гелевий |
3,9 |
1,3 |
Слабкокислотний гелевий |
11 |
4,23 |
Низкьоосновний гелевий |
4,7 |
1,25 |
Сильнокислотний макропористий |
4,3-4,5 |
1,95 |
Високоосновний макропористий |
3,7-3,9 |
1,15 |
Порівняння сорбційної ємності мінералів по залізу та марганцю в статичних умовах та в „киплячому шарі”.
Всі мінерали в статичних умовах проявляли свої сорбційні властивості менш активно до марганцю, ніж до заліза. При сорбції в ”киплячому шарі” спостерігалась зворотна залежність: ступінь вилучення по залізу менше ступеня вилучення по марганцю. Це можна пояснити тим, що іони марганцю легше осаджуються на оновлену поверхню „ефект „киплячого шару”), а іони заліза – на вже осаджену домішку заліза. Тому ємність по іонам заліза у всіх мінералів в статичних умовах вища, ніж по іонам марганцю.
4. Кислотно основні властивості іонітів.
Насамперед пов'язують із дисоціацією Н-форми катіоніту (кислоти) і утворенням вільних катіонів Н+, а також із дисоціацією ОН-форми аніоніту (основи) і утворенню вільного іона гідроксилу ОН-. Основа таких уявлень - теорія кислот і основ Арреніуса і Бренстеда (дисоціація кислот на Н и аніон, основ - на ОН і катіон). Про силу кислот і основ судять по кривим , які характеризують зміну рН розчину кислоти (основи) при додаванні в нього основи (кислоти) - кривим титрування. Застосовують цю теорію до іонітів, тому що іоніт можна уподібнити кислоті або основі за здатністю до дисоціації.
Поводження Н-форми катіоніту та ОН-форми аніоніту, подібно до кислот і основ кількісно характеризується константою дисоціації, найбільш поширеним засобом визначення якої є метод потенціометричного титрування. Криві потенціометричного титрування зернистих іонітів за формою нагадують криві титрування кислот і основ, але йдуть більш полого, а стрибки рН поблизу точки еквівалентності позначені менш чітко.
Одержання кривих титрування твердих іонітів є складним (для сильнодисоційованих іонітів рівновага встановлюється через 1-2 год, для слабких – через тижні), тому про силу іонітів судять побічно по кривим титрування гетерогенної суміші - суспензії іоніту у воді кислотно-основні властивості іонітів, що відбивають, у неточному вигляді (для усунення цього дефекту в середовище, що титрується попередньо вводять нейтральні солі, наприклад (NaCl) або використовують достатньо здрібнений іоніт.
Для сильнокислотних і сильноосновних іонітів поняття про ємність цілком визначене - вона залежить від природи і концентрації розчину, що насичує, у широкому інтервалі рН. На малюнку подані схематичні криві зміни обмінної ємності різноманітних типів катіонітв із зміною рН розчину.
Крива 1 відноситься до монофункціонального сильнокислотного іоніту, показує сталість його обмінної ємності в широкому інтервалі значень рН. Іоніт у Н- формі в присутності NaCl титрують NaOH. При цьому протікає і/о: іоніт переходить із Н-форми в солеву форму:
R-H+ + Na+-↔ R-Nа+ +H+ (1).
Звільнені іони Н з'єднуються з іонами ОН- що добавляється з основою і ведуть реакцію до завершення, тобто утворенню води:
Н+ + ОН-=Н2О (2).
Тому рівновага обміну (1) зрушується вправо. Це означає, що додані іони Nа+ практично цілком поглинаються іонітом доти, поки останній містить іони Н+. У той же час значення рН водної фази майже не змінюється, тому що до насичення іоніту Na практично всі іони ОН нейтралізуються вільними іонами Н+. .Як тільки іоніт віддасть усі іони Н+ (виснажиться), при подальшому додаванні основи, рН розчину різко зросте.
Слабкокислотна смола (на рис. - крива 2) поводиться інакше, тому що її кислотні групи слабкодисоційовані, обмінна реакція (1) залишається незавершеною і рН розчину зростає прогресивно навіть на перших етапах титрування. Різке зростання можливо коли смола цілком переходить у Nа- форму. При дуже низьких значення рН обмінна ємність дорівнює практично 0; при підвищенні рН до деякого значення (яке залежить від Кд - т.А) обмінна ємність починає проявлятись та при збільшенні рН зростає. При доведенні рН до деякої величини (т.В), обмінна ємність досягає максимуму та більше не змінюється.
Якщо катіоніт поліфункціональний (крива 3), то спостерігається послідовність у дисоціації його функціональних груп, аналогічна дисоціації двохосновних кислот. Як і для кислот, по витраті основи до стрибка рН можна обчислити максимальну ємність іоніту (вагову або об'ємну). Так , для 1 - вагова ємність = 5,3 мг- екв/г; для 2 - 9,7 мг-екв/г; для 3 - можна визначити як ємність сильних, так і слабких груп: відповідно 2 мг-екв/г і 5,5 мг-екв/г.
Для низькоосновних і поліфункціональних аніонітів, вплив рН на зміну обмінної ємності прямо протилежний (підвищення обмінної ємності зі зниженням рН).

Потенціограми катіонітів (1 – сильнокислотний, 2- слабкокислотний, 3- середньокислотний) та аніонітів
Для кількісного опису цих кривих користуються напівемпіричними рівняннями:
для
катіонітів рКкат-рН=lg
![]()
для аніонітів рКан-рОН=lg
де рКкат, ан=-lgКкат, ан - називається константою дисоціації, що здається, яка деякою мірою (побічно) відбиває силу іоніту.
α - ступінь іонізації функціональних груп (звичайно = 0,5, тобто 50% насичення слабкого іоніту іонами Na)
Тому рівняння приймають вигляд:
рКкат= -lg Ккат = рН
рКАН=-lg Кан=14-рН=рОН.
Ними можна користуватися для експериментальної оцінки КД функціональних груп Н і ОН - форм іонітів. Практично реалізується.
Для сильноіонізованих іонітів характерна можливість 100% реалізації ПОЄ в будь-який іонній формі і при будь-якому складі оброблюваного розчину. Слабкоіонізовані іоніти не вступають у реакції обміну із солями кислот і основ, більш сильних, ніж іоніт (тобто ємність їх залежить від рН), що обумовлює межу їх придатності.
Криві потенціометричного титрування дозволяють: 1) кількісно оцінити кислотно-основні властивості іонітів 2) характер функціональних груп 3) розрахувати їх обмінну ємність 4) оцінити і вибрати в першому наближенні оптимальне значення рН середовища при сорбції й оптимальній концентрації розчину кислоти або лугу при регенерації (ємність із зменшенням рН знижується, катіоніт не може сорбувати Ме, але може Н - можлива повна регенерація => регенерацію можна проводити при малих концентраціях).
Про кислотно-основні властивості неорганічних катіонітів судити важко в зв'язку з нестійкістю їх Н-форм.
6. Набухання іонітів.
Явища набухання тіл у воді відомі давно. Спостерігається в різноманітних проявах: вичинка шкіри, гончарне виробництво, ходьба по розмоклій дорозі та інш.
Набуханням називається процес поступового збільшення об'єму твердого тіла, який розміщено в рідкий розчинник (воду), за рахунок проникнення води всередину тіла. Набухання може бути різноманітним в різних областях і характеризується ступенем (коефіцієнтом) набухання. Зворотній процес - усихання набухшого тіла.
Для гелевих структур (іонітів) набухання є аналогічним розчиненню і викликається тими ж причинами (з точки зору термодинаміки причина набухання - в розходженні хімічного потенціалу розчинника в ненабухшому іоніті та в зовнішньому розчині, тобто розчинник з зовнішнього розчину з більш високою потенційною енергією намагатиметься перейти в іоніт).
Отже, можна вважати, що набухше тіло це розчин, який складається з двох компонентів –твердого (матриці іоніту) і рідкого (води всередині іоніту).
Набухання іонітів - входження полярного розчинника (води) у зерна іоніту, яке супроводжується розтягуванням полімерної матриці та обмежене наявністю ланок, що зшивають іоніт. Це - важлива властивість іонітів, що забезпечує швидке протікання іонного обміну і встановлення рівноваги; істотно впливає на кінетику і/обм. процесу. Обмін в набухших іонітах йде набагато швидше, ніж це можливо у твердих тілах та ненабухших іонітах.
Об'єм змінюється в зв'язку зі зміною гідратації активної групи:
Зерна органічних молекул або продуктів конденсації нерозчинні у воді тому, що полімерні ланцюги макромолекул не тільки мають велику молекулярну масу, але ще поперечний зв'язані між собою, як би утворюючи просторову сітку потенційно пористої речовини. У іонітів звичайно немає пор у вигляді стабільних отворів і проходів певних мікроперетинів, як, наприклад у активованого вугілля, у зерен іонітів також немає стабільних геометричних розмірів. Вони здатні набухати у воді і декілька менше в інших органічних розчинниках.
Проте безмежному набуханню, що граничить з розчиненням, перешкоджають поперечні зв'язки.
Конкретних причин набухання дві: 1) наявність полярних функціональних груп, спроможних до гідратації, тобто до притягання в своє безпосереднє оточення молекул води (розчинника) і до утримання в іоніті протиіонів 2) наявність протиіонів, спроможних до гідратації і незалежного руху, до змішування з молекулами розчинника.
Найбільш сильно набухають іоніти у воді. Для більшої частини іонітів характерне зростання об'єму при набуханні в 1,5 – 3,5 рази – це значний розбіг розмірів, і він повинен враховуватися при завантаженнях іонітів в іонообмінні фільтри.
Набухання для попередження здрібнювання зерен рекомендовано проводити не у воді, а в розчині електроліту (н-д, NaCl) або при нагріванні.
На набухання впливає: 1) заряд протиіонів в іоніті [(відповідно до т/д, у рівновазі з зовнішнім розчином іоніт з однозарядними іонами поглинає води більше, ніж іоніт із двохзарядними іонами (тому що в насиченому однозарядними протиіонами розчині їх в 2 рази більше, ніж у насиченому двохзарядними) і тому, що багатозарядні іони сильніше взаємодіють із функціональними групами, ніж однозарядні]. Серед одновалентних краще набухають ті, у яких радіус менше, тому що в них щільність заряду на поверхні вище і вони сильніше притягають диполі розчинника;
Звичайно однозарядні іони, особливо водню і гидроксида, приводять до найбільшого набухання; багатозарядні протиіони приводять до деякого стиснення і зменшення об'єму зерен.
2) ступінь зшивки іоніту (чим сильніше зшитий, тим слабкіше його набухання, але тим більше зростає його механічна міцність);
3) концентрація і склад зовнішнього розчину (у більш концентрованих розчинах набухання значно слабкіше);
4) природа функціональних груп. Набухання сильноіонізованих Н-катіоніту та ОН-аніоніту максимально, а слабкоіонізованих - мінімально в порівнянні з відповідними солевими формами.
5) рН середовища. Катіоніти при зміні рН від нейтральної до кислої – стискаються, до лужної – набухають. Аніоніти – навпаки.
Якщо розглядають водяні розчини, то набухання називають гідратацією. Щоб уникнути порушення гідродинамічного та аеродинамічного режиму іонітового прошарку і поломок устаткування варто враховувати можливості різкої зміни його об'єму.
У процесі гідратації або набухання іоніту, вільна енергія буде дорівнює різниці добутку концентрації іонів у фазі розчину і іоніту на відповідні хімічні потенціали:
![]() (1)
(1)
Вираз для потенціалів має вигляд:
![]() (2)
(2)
![]() (3)
(3)
Тиск набухання позначають П і в якості його приймають такий міn тиск, який варто прикласти ззовні для того, щоб зерно іоніту, поглинаючи розчинник, не збільшувалося в обсязі. Продиференциювавши (3) по П при постійній температурі та після скорочення:
![]() (4)
(4)
З хімічної т/д відомо
![]() (5)
(5)
Підставляючи (3) в (4):
![]() (6)
(6)
Після інтегрування і розділення перемінних одержуємо:
![]() ,
звідки
,
звідки
![]() , (7)
, (7)
тобто тиск набухання визначається концентрацією іонів у фазі іоніту і можливої зміни його об'єму. Поглинання розчинника іонітом має місце в результаті проникнення молекул розчинника в простір між вуглеводними ланцюжками і молекулами зшивки. При цьому збільшенню обсягу зерен у певній мірі перешкоджають сили, що утримують воєдино каркас (матрицю) зерна іоніту.
Таким чином, загальний тиск, що протидіє набуханню можна представити у вигляді:
![]() (8)
(8)
де Ро - зовнішній тиск;
Рзш - частина тиску набухання, сприйманого зчепленими вуглеводними ланцюгами і молекулами зшивки. (Також справедливо і таке вираження для тиску набухання П= Р-Р; Р- тиск, під яким знаходиться розчинник у фазі іоніту, Р- атмосферний тиск). В результаті підстановки (8) у (7) , зміна об'єму при набуханні:
![]() (9)
(9)
На практиці часто використовують емпіричний вираз для розрахунку зміни об'єму зерен іоніту при їх попаданні в розчинник:
![]()
де Vнаб, Vсух- об'єми сухого і набухлого іоніту, що припадають на 1 г-екв функціонально - активних груп; А - емпірична константа; Сзш – вміст речовини, що виступає в якості зшивки (найчастіше дивінілбензол).
Питання про агрегатний стан набухлого іоніту. Фаза іоніту - своєрідний дволикий Янус, що сполучає властивості рідких і твердих тел. Класична т/д припускає існування таких фаз із складними властивостями, розглядаючи їх як тверді щодо одних своїх компонентів і рідкі щодо інших. Дослідження води в набухлому іоніті методами ЯМР, спектроскопії та інш., підтверджує, що вона є рідкою. Проте набухлий іоніт - не просто просочене рідиною тверде тіло. Усе говорить про те, що стан рідини в іоніті відрізняється від її стану в зовнішньому розчині. Питання про агрегатний стан розчинника в іоніті вирішується тільки в крайніх випадках - сильно набухлого та в початковий момент. У сильно набухлого - ця рідина, очевидно, в початковий момент має властивості твердого тіла. На питання, чи не є іоніт двохфазною системою, що складається з твердої і рідкої фази, немає однозначної відповіді. У рамках класичної термодинаміки набухлий іоніт - особлива єдина фаза, що сполучає у собі обидва агрегатних стани - рідкого і твердого. Проте можливий і локальний термодинамічний підхід, що дозволяє вважати набухлий іоніт двохфазною системою.
7. Селективність (вибірковість) і специфічність іонітів.
Для найбільш ефективного видалення шляхом сорбції з розчину речовини, потрібно іоніт у стані рівноваги істотно збагатити цією речовиною в порівнянні з розчином.
Селективність (або вибірковість) - краще поглинання одного з протиіонів та збагачення ним іоніту. Причиною, що викликає селективність і/о, є розходження енергії тяжіння різних іонів іонітом, обумовлені в першу чергу розміром радіусу сорбованих іонів та їх зарядів. Селективність залежить від величину тиску набухання в порах іоніту та від розміру пор іоніту.
Мірою
збідніння або збагачення іоніту даною
речовиною є об'ємний
коефіцієнт розподілення
КА,
який дорівнює відношенню концентрацій
сорбованої речовини А в іоніті до його
концентрації в розчині):
![]()
Очевидно, що при КА<1 сорбент збіднений, а при КА>1 збагачений речовиною в порівнянні з рівноважним розчином. Коефіцієнт розподілення часто застосовують для попередньої оцінки виборчої сорбційної спроможності іоніту.
Проте звичайно бажано відокремити потрібний іон від інших іонів розчину, для чого необхідно збагатити іоніт цим іоном і збіднити іншими іонами. Іншими словами необхідно, аби іоніт виявляв селективність стосовно обраного іона в порівнянні з іншими. На думку спеціалістів найзручніша міра вибірності - коефіцієнт селективності, який дорівнює відношенню коефіцієнтів розподілення конкуруючих іонів А и В:
![]()
При КА,В>1 іоніт селективний до іону А, при КА,В<1 вибірково сорбується іон В. При КА,В=1 іоніт не виявляє селективності до жодного з іонів і розділити їх не можна. Коли іоніт виявляє особливо велику селективність до іону або групи іонів у порівнянні з меншою вибірністю до інших іонів, має місце особливий вид селективності - специфічність. Специфічність зв'язують звичайно з особливостями хімічної взаємодії сорбуємого іону з фіксованими іонами або ж із структурними особливостями іоніту і сорбуємих іонів (ситовий ефект).
Для реальних і/обм. систем коефіцієнти вибірності різноманітні для різних положень рівноваги і необхідно загальне порівняння різних систем за селективністю. Його проводять, розташовуючи елементи в ряд по зростанню або зменшенню середніх значень коефіцієнтів - якісна характеристика селективності іонітів до різноманітних іонів (за енергією їх витискування).
Для обміну однозарядних іонів для сильнокислого катіоніту справедливий ряд:
![]() .
.
Кожний наступний член ряду сорбується іонітом більш селективно, ніж попередній, тому що в розчині вони з'являються в порядку зліва направо.
Селективність зростає при: 1) збільшенні радіуса негідратованого іону; 2) зменшенні радіусу гідратованого іона; 3) зменшенні енергії активації; 4) збільшенні ступеня зшивки, що зменшує його набухаємість.
Селективність двозарядних іонів для сильнокислих катіонітів характеризується рядом:
![]() .
.
Для полістирольних слабкокислотних катіонітів, у яких карбоксильна група приєднана до бензольного кільця, для однозарядних іонів характерний такий ряд:
![]() ,
,
тобто спостерігається тенденція до обертання ряду селективності сульфокатіонітів, як і для двозарядних іонів:
![]() .
.
На відміну від сильнокислотних, слабкокислотні катіоніти виявляють особливо високу спорідненість до іону Н, тому вони не мають обмінну ємність у достатньо кислих середовищах.
Для слабкокислих (карбоксильних) катіонітів характерна тенденція до обертання ряду селективності в порівнянні з рядом для сильнокислотних сульфокатіонітів.
У слабокислотнихних катіонітів більш чітко ніж у сильнокислотних катіонітів, виявляється розходження в селективності до іонів різного заряду, що пояснюється більш сильною електростатичною взаємодією іонів більшого заряду з карбоксильними групами та інш властивостями.
Узагальнені ряди селективності (з коефіцієнтами селективності) для:
катіоніту КУ-2-8
![]()
катіоніту КБ-4
![]()
катіоніту Duolite C20:
![]() .
.
В літературі та технічних паспортах на іоніти зустрічаються різноманітні ряди селективності іонів різних зарядів для різноманітних іонітів по зростаючій (або убуваючій) спроможності їх до сорбції.
Аніонний обмін краще вивчений для сильноосновних аніонітів з полістирольною матрицею. Низька селективність сильних аніонітів до ОН-іону означає, що їх ОН-форми - сильні основи. Звертає на себе увага низька селективність до аніонів слабких кислот (борної, кремнієвої, вугільної) і дуже висока, н-д, до аніонних комплексів ПАР, що сорбуються так міцно, що не можуть бути десорбовані NaOH.
![]()
![]()
Низькоосновні аніоніти мають високу селективність до гідроксид-іонів, а також аніонів сильних мінеральних кислот із кислих середовищ, а селективність до аніонів слабких кислот настільки мала, що останні практично не сорбуються.
При десорбції (регенерації) ряди селективності мають властивість обертатися.
Шляхом зіставлення гідродинамічних параметрів обміну складені та широко застосовуються для очищення розчинів ряди селективності для неорганічних природних і штучних іонітів з врахуванням специфіки їх будови.
Варто врахувати, що при розрахунках селективності сорбованих іонів приймається радіус гідратованих іонів (гідратна оболонка з дипольних молекул води). Так, загальна селективність (переважна сорбція іонів, обумовлена радіусом і зарядом іонів), а специфічна селективність - специфічність - переважна сорбція іонів, обумовлена явищами поляризації.
Цікава ідея синтезу іонітів, селективних до певного іону чи групі іонів. Проводяться досліди, але частково їх селективні властивості погіршуються при введенні в матрицю іоніту. Важлива властивість цих іонітів - можливість керувати їх селективністю шляхом зміни зовнішніх умов, зокрема рН. На їх застосуванні засновані нові методи лікування в медицині - гемосорбція і гемодіаліз. Смола з ЕДТК - має велику селективність до Са.
При роботі фільтру, працюючий шар іоніту пересувається вниз і через певний час після включення фільтру утворюється робоча зона, зона виснаженого і свіжого катіоніту. Всередині працюючої зони катіони поглинальні з оброблюваної води, утворюють відповідні підзони, розташування яких по висоті пов'язане з переважною сорбцією (селективністю)
у ряді катіонів:
Ti+ Ba2+ La3+ GЗ+ Pb2+ Ag+ Cr2+ Sr2+ Ca2+ Mп2+ Be2+ Ni2+ Cg2+ Cu2+ Co2+ Mg2+ Cs+ Rb+ K+ NH4+ Na+ H+ Li+
та аніонів:
J- HSO4- NO3- Br- NO2- С1- НСО3- НSiO3- F- Н2ВО3- ОН-
Ряд активності іонів показує, що при приблизно рівній концентрації іонів в розчині, кожен попередній іон поглинається активніше, ніж подальший і витісняє його з матриці смоли. Менш рухомі іони уловлюються лежачими нижче шарами і першими проскакують у фільтрат при насиченні фільтру.
Поліамфоліти
АНКБ-2:
![]()
АНКБ-2:
![]()
