
ФИЗИЧЕСКИЕ СВОЙСТВА НЕФТЕЙ
.pdf
vk.com/club152685050 | vk.com/id446425943
275
течения жидкости: v(1) =1566, м/с. Затем проверяем справедливость сделанного допущения. Имеем:
νн ар. = 5 exp[−0,0693 (10 −50)]= 79,95сСт;
λн ар. = |
|
0,3164 |
|
0,0292 ; |
||
4 1,566 |
0,7 (79,95 10−6 ) |
|||||
|
|
|
||||
k =1 4 0,0693 |
(50 −10)= 0,693 ; |
|||||
m = |
|
4 3,5 120000 |
0,881; |
|||
1,566 0,7 870 2000 |
||||||
k exp(−m)= 0,693 exp(−0,881) 0,287;
λэф. = 0,0292 0,8811 [Ei(−0,693)−Ei(−0,287)]=
=0,0292 0,8811 [−0,379 −(−0,939)] 0,0186 < λэф. = 0,02.
Поскольку между принятым и рассчитанным λэф. суще-
ствует различие, сделаем второе приближение.
2-е приближение. Положим λэф.(2) = 0,0186 . Тогда из уравнения (*) находим новую скорость течения жидкости: v(2) =1611, м/с. После этого опять проверяем справедливость сделанного допущения. Имеем:
κ = 0,0693 1 0 С; νнар. = 79,95 сСт;
0 С; νнар. = 79,95 сСт;
λн ар. |
= |
0,3164 |
|
0,0290 ; |
|
4 1,611 0,7 (79,95 10−6 ) |
|||||
|
|
|
|||
k =1 4 0,0693 (50 −10)= 0,693 ; |
|||||
m = |
|
4 3,5 120000 |
0,856 ; |
||
1,611 0,7 870 2000 |
|||||
k exp(−m)= 0,693 exp(−0,856) 0,294 ;

vk.com/club152685050 | vk.com/id446425943
276
λэф. = 0,029 0,8561 [Ei(−0,693)−Ei(−0, 294)]=
=0,029 0,8561 [−0,379 −(−0,921)] 0,0184 ≈ 0,0186 = λэф.(2) .
Поскольку для принятого и рассчитанного коэффициентов λэф. получено хорошее совпадение, процесс
последовательных приближений заканчивается. Таким образом, v 1611, м/с и, следовательно, Q = 2231 м3/ч. При
этом температура нефти в конце участка рассчитывается по формуле (91) В.Г. Шухова:
TL =10 +(50 −10) exp(−0,856) 270 C .
2.10. Физические свойства природных газов
161. Молярная масса µ газовой смеси рассчитывается
по последней из формул (105):
j=3
µ=∑xjµj =16,042 0,99+28,016 0,005+30,068 0,005=16,172.,
j=1
R = Rµ0 = 16,1728314 514,1Дж/(кг К).
162. Задача решается аналогично предыдущей.
j=3
µ=∑xjµj =16,042 0,88+28,016 0,02+30,068 0,06+
j=1
+44,094 0,04=18,245,
R = Rµ0 = 18,2458314 455,7 Дж/(кг К).
163. Используя закон (101) Клапейрона-Менделеева

vk.com/club152685050 | vk.com/id446425943
277
p V = mµ R0T ,
получаем уравнение для определения массы m газа
101300 105 = 19,2m 8314 293 ,
из которого находим: m 79842 кг.
164. Используя формулу (101), получаем:
101300 2,5 105 = 18,5m 8314 293.
Отсюда находим: m 192,328 кг.
165. Нормальные условия (н) отличаются от стандартных (с) температурой: в первом случае она равна 0 0С, во
втором +20 0С. Имеем: |
|
|
|
|
|
|
|
|
|
|
|||||||||||
p |
|
|
V |
= |
m |
R T |
; p |
|
V |
= |
m |
R |
T |
. |
|
|
|||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
атм. |
|
н. |
µ |
|
0 н. |
|
атм. |
c. |
µ |
|
0 c. |
|
|
|
|||||
Следовательно, Vн. Vс. |
= Tн. |
Tc. . Отсюда получаем: |
|
|
|||||||||||||||||
|
Vн. |
|
|
|
273 |
|
|
|
|
|
|
|
|
|
4 |
3 |
|
||||
|
|
|
= |
|
|
|
|
|
|
0,93174 или V |
=0,9317410 =9317,4 |
м |
. |
||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
Vс. |
|
|
273 + 20 |
|
|
|
|
|
н. |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
166. Аналогично решению предыдущей задачи, имеем: |
|
||||||||||||||||||||
Vн. |
|
Vс. = Tн. |
Tc. . Отсюда получаем: |
|
|
|
|
||||||||||||||
V |
= V |
|
Tс. |
= 5 104 |
273 + 20 53663м3. |
|
|
||||||||||||||
|
|
|
|
||||||||||||||||||
|
|
с. |
|
|
н. |
|
T |
|
|
|
273 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
н. |
|
|
|
|
|
|
|
|
|
|
|
|
||
167. Согласно закону Клапейрона-Менделеева, имеем: |
|
||||||||||||||||||||
pдн.Vр. = RTдн. ; pнч.Vр. = RTнч. |
pдн. pнч. = Tдн. Tнч. . |
|
|
||||||||||||||||||
Здесь индексы дн. и нч. Относятся к значениям дневных и ночных параметров газа, соответственно. Далее имеем:
pдн. = 273 ++20 1,0427 , то есть pдн. =1,0427 pнч. . pнч. 273 8

vk.com/club152685050 | vk.com/id446425943
278
Кроме того, известно, что 1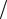 2 (pдн. + pнч. )= 0,11 МПа. С
2 (pдн. + pнч. )= 0,11 МПа. С
учетом этого условия имеем систему уравнений для определения давлений pдн. и pнч. :
|
pдн. |
+ pнч. = 0,22, |
|
|||||
|
|
|
|
|
|
. |
|
|
|
pдн. |
=1,0427 pнч. |
|
|||||
Решив |
эту |
систему, |
получим: pнч. = 0,1077 МПа, |
|||||
pдн. = 0,1123 |
МПа. Таким образом, суточные колебания |
|||||||
давления составляют ± 0,0023 МПа. |
||||||||
168. Согласно закону Клапейрона-Менделеева |
||||||||
p V = |
m |
R |
T . |
|
||||
|
|
|||||||
|
|
|
µ |
0 |
|
|
|
|
Поскольку величины V,m,µ неизменны, то |
||||||||
|
p2 |
= |
T2 p |
|
= p T2 |
, |
||
|
|
|
||||||
|
p |
T |
|
2 |
1 T |
|
||
1 |
|
1 |
|
|
1 |
|
||
где индекс 1 относится к начальному состоянию газа, а индекс 2 – к новому. Отсюда имеем:
p2 = 0,12 273273++1530 0,1263МПа.
169. Поровый объем Vп. газа определяется формулой
Vп. = m s πab h ,
где πab − площадь эллипса. В данном случае:
V |
= 0,3 0,65 3,14 3000 2000 15 55,1 106 м3. |
||||||||
п. |
|
|
|
|
|
|
|
|
|
Масса М газа в газовой полости ПХГ вычисляется по |
|||||||||
формуле M = ρVп. , где ρ − плотность газа в пластовых ус- |
|||||||||
ловиях. Имеем: |
|
|
|
|
|
|
|||
|
|
|
|
|
10 106 |
|
273 +30 −3,668 |
|
|
Z =1−0,4273 |
|
|
|
|
0,802 ; |
||||
4,7 106 |
|
||||||||
|
|
|
|
|
|
|
200 |
|
|
ρ = |
|
p |
= |
|
10 106 |
|
|
87,556 кг/м3; |
|
|
ZRT |
0,802 470 303 |
|||||||
|
|
|
|
|
|||||
vk.com/club152685050 | vk.com/id446425943
279
M = ρVп. = 87,556 55,1 106 4,824 109 кг.
Плотность ρст. газа при стандартных условиях рассчитывается по формуле ρст. = pст.  RTст. (здесь Zст. =1). Имеем:
RTст. (здесь Zст. =1). Имеем:
ρст. |
= |
0,1013 106 0,736 кг/м3. |
|||||
|
|
|
470 293 |
|
|
||
Следовательно, объем V |
газа, выраженный в стандартных |
||||||
|
|
|
|
|
ст. |
|
|
кубических метрах, определяется равенствами: |
|||||||
V |
= |
|
М |
= |
4,824 109 |
6,554 109 м3. |
|
|
|
0,736 |
|||||
ст. |
|
|
ρст. |
|
|
||
170. Поровый объем V |
вмещающих пород, занятых га- |
||||||
|
|
|
|
|
|
п. |
|
зом в конце периода отбора, вычисляется следующим образом:
V |
=m sπabh=0,3 0,35 3,14 3000 2000 15 29,673 106 м3. |
|||||||
п. |
|
|
|
|
|
|
|
|
Масса M газа в хранилище рассчитывается так же, как |
||||||||
и в предыдущей задаче: |
|
|
|
|
||||
|
|
8,5 |
106 |
|
273 +30 |
−3,668 |
|
|
Z =1−0,4273 |
|
|
|
|
|
0,832 ; |
||
4,7 |
106 |
200 |
||||||
|
|
|
|
|
||||
ρ = |
p |
= |
8,5 106 |
71,739 кг/м3; |
|
||||
|
|
|
0,832 470 303 |
|
|||||
|
ZRT |
|
|
|
|||||
M = ρV |
= 71,739 29,673 106 2,129 109 кг. |
|
|||||||
|
|
п. |
|
|
|
|
|
|
|
Плотность ρст. газа при стандартных условиях была |
|||||||||
найдена |
при |
|
решении |
предыдущей |
задачи: |
ρст. = 0,736 |
|||
кг/м3, поэтому его объем V |
, выраженный в стандартных |
||||||||
|
|
|
|
|
|
ст. |
|
|
|
кубических |
метрах, |
находится |
согласно |
равенству |
|||||
M = ρст.Vст. : |
|
|
|
|
|
|
|||
V |
= |
М |
= |
2,129 109 2,893 109 м3. |
|
||||
|
|
||||||||
ст. |
|
ρст. |
|
0,736 |
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
280
Учитывая результаты расчетов, полученные при решении предыдущей задачи, находим, что из ПХГ отобрано
(6,554 − 2,893) 109 = 3,661 109 м3,
что составляет примерно 56 % объема газа, находившегося в хранилище первоначально.
171. Используя закон (101) Клапейрона-Менделеева p V = mµ R0T ,
получаем уравнение для определения массы m газа
1,5 106 100000 = 19,5m 8314 (273 + 25),
из которого находим: m 1180591 кг≈1180,6 т.
172. Критическая температура метана составляет 190,55 К. При более высоких температурах, метан может находиться только в газообразном состоянии вне зависимости от давления.
Критические параметры метана равны, как известно: pкр. = 4,641 МПа, Tкр. =190,55 К (или -82,45 0С). Таким обра-
зом, при давлении 20 МПа, которое намного выше критического, и температуре –110 0С (или 163 К), которое намного ниже критического, газ находится в жидком состоянии.
173. Средние значения критического давления и критической температуры смеси можно рассчитать по формулам
(105):
pкр.см. = 4,641 0,94 +4,913 0,04 +3,396 0,02 4,627 МПа, Tкр.см. =190,55 0,94 +305,5 0,04 +126,25 0,02 193,86 К.
174. Средние значения критического давления и критической температуры смеси рассчитываются по формулам
(105):
pкр.см. = 4,641 0,92 +4,913 0,04 +3,396 0,02 +8,721 0,01+ + 7,382 0,01 4,695 МПа,

vk.com/club152685050 | vk.com/id446425943
281
Tкр.см. =190,55 0,92 +305,5 0,04 +126,25 0,02 +373,56 0,01+ + 304,19 0,01 196,83 К.
Затем определяем приведенные параметры газа p иT : p = 4,6956,5 1,384 , T = 273196,83+ 25 1,514 .
Наконец, по формуле (104) вычисляемZ(p,T): Z(p,T)=1−0,4273 1,384 1,514−3,668 0,871 .
175. Сначала рассчитываются молярная масса и газовая постоянная смеси:
µ=16,042 0,92 + 30,068 0,04 + 58,12 0,02 +
+28,016 0,01 + 34,900 0,01 17,753 кг/кмоль, R = Rµ0 = 17,7538314 468,3 Дж/кг К.
Затем определяются средние значения критических параметров газовой смеси:
pкр.см. = 4,641 0,92 +4,913 0,04 +3,570 0,02 +3,396 0,01+ +8,721 0,01 4,659 МПа,
Tкр.см. =190,55 0,92 +305,5 0,04 +407,90 0,02 +126,25 0,01+ + 373,56 0,01 200,68 К.
Рассчитываются приведенные параметры газовой сме-
си:
p = 4,6597,0 1,502 , T = 273200,68+15 1,435
и по формуле (104) вычисляется коэффициент Z(p,T) сжи-
маемости: |
|
|
|
|
|||
|
|
)=1 |
−0,4273 1,502 1,435−3,668 0,829 . |
||||
Z(p,T |
|||||||
После этого находится плотность ρ газа: |
|||||||
ρ = |
|
p |
= |
|
7 106 |
62,61кг/м3. |
|
ZRT |
|
0,829 468,3 288 |
|||||
|
|
|
|
||||

vk.com/club152685050 | vk.com/id446425943
282
176. Уравнение равновесия газа, находящегося в скважине под действием собственного веса имеет вид:
dpdy = −ρg,
где p(у)− давление; ρ = p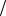 ZRT −плотность газа; g − уско-
ZRT −плотность газа; g − уско-
рение силы тяжести, а ось Y направлена вертикально вверх. Отсюда получаем дифференциальное уравнение для
p : |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
dp |
|
= − |
p |
|
g |
|
или |
dp |
= − |
|
|
p |
|
g |
. |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
dy |
|
|
Z |
RT |
|
dy |
|
1−0,4273 p T−3,668 |
|
RT |
||||||||||
Разделив обе части уравнения на pкр. , получим: |
|
|
|
||||||||||||||||||
1 |
|
|
|
|
|
|
|
|
−3,668 |
|
|
g |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
−0,4273 |
T |
|
dp = − |
|
dy . |
|
|
|
||||||||||
|
|
|
RT |
|
|
|
|||||||||||||||
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Интегрируя это уравнение по p от pзб. pкр. |
до pуст. pкр. |
||||||||||||||||||||||
и по у от 0 до L, где L − глубина скважины, получаем: |
|||||||||||||||||||||||
ln |
pуст. |
|
|
|
|
|
|
−3,668 |
|
(pуст. − pзб. )= − |
gL |
|
|
||||||||||
−0,4273 T |
|
|
|
||||||||||||||||||||
pзб. |
|
|
|
|
RT |
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
p |
|
|
|
|
gL |
|
|
или0,4273 T−3,668 pуст. |
зб. |
|
|
зб. |
|
|
|
|
|
||||||||||||||
|
|
|
−1 −ln |
|
= − |
|
. |
|
|||||||||||||||
|
|
|
pуст. |
RT |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
pуст. |
|
|
|
|
|
|
||||||||
Подставив сюда исходные данные из условия задачи, |
|||||||||||||||||||||||
найдем: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
303 |
−3,668 |
|
7,0 |
(x |
−1)−lnx |
= − |
9,81 1000 |
, |
||||||||||||
0,4273 |
|
|
4,7 |
|
470 303 |
||||||||||||||||||
|
|
|
195 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
гдеx = pзб. |
pуст. . Отсюда получаем трансцендентное урав- |
||||||||||||||||||||||
нение: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,12637 x − ln x = 0,05748 , |
|
|
|
|
|
|
|
|
|
||||||||||||||
которое решаем методом последовательных приближений. В результате решения находим: x 1,083 . Следовательно,
давление pзб. =1,083 pуст. =1,083 7,0 7,58 МПа.

vk.com/club152685050 | vk.com/id446425943
283
Таким образом, давление на забое 1000-м скважины на 0,58 МПа ( ≈ 6 атм.) больше, чем на ее устье. Эта разность обусловлена весом газового столба в скважине.
177. 1) Поскольку газ считается совершенным, справедливы следующие равенства:
pн. = ρн.RTн. , pк. = ρк.RTк. pн. = ρн. Tн. ,
pк. ρк. Tк.
где индекс н. обозначает параметр газа в начале участка газопровода, а к. – в его конце.
Далее имеем:
ρн. = pн. Tк. = 5,5 283 1,468 . ρк. pк. Tн. 3,5 303
2) Откажемся теперь от предположения о совершенности газа. Уравнение состояния в этом случае будет иметь
вид: p = Z(p,T)ρRT . Поэтому вычислим приведенные
параметры газа в начале и в конце участка газопровода. Имеем:
pн. = 5,5 4,6 1,196, Tн. = 303 190 1,595 ; pк. = 3,5 4,6 0,761, Tн. = 283 190 1,489 .
Далее находим коэффициент Z сжимаемости газа: Zн. =1 − 0,4273 1,196 1,595−3,668 0,908 ,
Zк. =1 − 0,4273 0,761 1,489−3,668 0,925.
После этого вычисляем отношение плотностей газа:
ρн. = pн. Tк. Zк. = 5,5 283 0,925 1,495 . ρк. pк. Tн. Zн. 3,5 303 0,908
178. Согласно второй из формул (107), имеем:
T |
ρ |
γ−1 |
p |
|
γ−1 |
|
γ−1 |
|
||||
γ |
|
|
|
|
|
|||||||
|
|
γ |
|
|||||||||
2 |
= |
|
|
= |
|
|
= ε |
|
|
, |
||
ρ1 |
|
|
|
|||||||||
T1 |
|
|
p1 |
|
|
|
|
|
||||

vk.com/club152685050 | vk.com/id446425943
284
где T2 − температура газа на выходе из нагнетателя; T1 = 288 К – температура на его входе. Отсюда находим:
|
1,34−1 |
|
||
T |
|
|
|
324,5 К. |
= 288 1,6 1,34 |
||||
2 |
|
|
|
|
Таким образом, в результате адиабатического сжатия температура газа увеличивается примерно на 36,5 0С.
179. В политропическом процессе давление p и темпе-
ратура T газа связаны уравнением
m−1
T = p m , T1 p1
где p1 ,T1 − давление и температура газа, соответствующие
некоторому (исходному) состоянию; а m − показатель политропы. Поскольку
p |
=1,4 , |
T |
= |
273 +30 |
1,0707, |
|
p |
T |
273 +10 |
||||
|
|
|
||||
1 |
|
1 |
|
|
|
то имеем уравнение для определения m :
|
m−1 |
|
|
ln1,0707 |
|
||
1,0707 =1,4 |
|
m−1 = log |
1,0707 = |
0,203 . |
|||
m |
|||||||
|
|||||||
|
|
m |
1,4 |
|
ln1,4 |
||
|
|
|
|
||||
Отсюда находим: m 1,255 .
180. Сначала поступаем так же, как и при решении предыдущей задачи – находим коэффициент m политропы:
|
T |
p |
|
m−1 |
|
|
273 +38 |
|
|
m−1 |
|
m−1 |
|||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
m |
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
= |
|
|
|
|
+15 |
=1,57 m |
1,0799 =1,57 m . |
||||||||||
|
T1 |
|
273 |
||||||||||||||||
|
p1 |
|
|
|
|
|
|
|
|
|
|
||||||||
Отсюда находим: |
|
|
ln1,0799 |
|
|
|
|
|
|
||||||||||
|
m −1 |
= log |
|
1,0799 |
= |
0,17 m 1,21. |
|||||||||||||
|
|
|
|
||||||||||||||||
|
m |
1,57 |
|
|
|
ln1,57 |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Поскольку, согласно (108) в политропическом процессе
