
- •3.1. Ідентифікація катіонів за сірководневою схемою
- •3.1.1. Характеристика реакцій катіонів першої та другої аналітичних груп:
- •3.1.1.1. Реакції катіонів і аналітичної групи
- •Порядок відкриття катіонів першої аналітичної групи у невідомому розчині
- •3.1.1.2. Реакції катіонів другої аналітичної групи
- •3.1.1.3. Відкриття катіонів і та іі аналітичних груп в окремих розчинах
- •3.1.2. Характеристика реакцій катіонів III, IV I V аналітичних груп:
- •3.1.2.1. Реакції катіонів ііі аналітичної групи
- •3.1.2.2. Реакції катіонів IV аналітичної групи
- •Хлорид феруму (ііі) FeCl3 з гексаціанофератом (ііі) калію
- •3.1.2.3. Реакції катіонів V аналітичної групи
- •3.1.2.4. Відкриття катіонів III, IV, V аналітичних груп у невідомому розчині
- •3.2. Аналітичні реакції аніонів
- •3.2.1. Реакції аніонів і аналітичної групи
- •Аніон сульфату - so42–
- •Аніон сульфіту – so32–
- •Аніон карбонату - сo32–
- •Аніон фосфату - ро43–
- •3.2.2. Реакції аніонів другої аналітичної групи аніонів
- •3.2.3. Реакції аніонів ііі аналітичної групи
- •Аніон ацетату – ch3coo–
- •Аніон нітриту – nо2–
- •Аніон нітрату - no3–
- •3.3. Аналіз солей
- •Література
- •Контрольні запитання
Розділ 3. ЯКІСНИЙ АНАЛІЗ (хімічні методи)
Слід розрізняти види якісного аналізу
За способом спостереження зовнішнього ефекту: хімічний (передбачає
виконання хімічних реакцій) та інструментальний (передбачає використання сучасних аналітичних приладів).
За класом ідентифікованої речовини: органічний (виявлення органічних
сполук) і неорганічний (виявлення мікроелементів).
За кількістю ідентифікованої речовини: макро- (0,1-1 г) , мікро-,(<0,001
г) напівмікро-(0,01 г), ультрамікро- (< 10−6 г) тощо.
За кількістю і типом ідентифікованих об'єктів: повний (ідентифікація
елементів, функціональних груп, молекул, фаз, які входять до складу досліджуваного об'єкту), частковий (ідентифікація окремих елементів, груп, молекул, іонів тощо в залежності від поставленої задачі), елементний (ідентифікація елементів, з яких складається досліджуваний об'єкт), функціональний (ідентифікація функціональних груп, які входять до складу молекули), молекулярний (ідентифікація молекул речовин, які входять до складу об'єкту), фазовий (ідентифікація фаз, які входять до складу об'єктів – тверда, рідка, газоподібна), речовинний (Визначення хімічної форми ідентифікованого компоненту. Наприклад, потрібно визначити у якому ступіню окиснення присутній елемент: As (III) чи As (V), або у якому хімічному стані присутній елемент: купрум знаходиться у мінералі у вигляді оксиду або сульфіду, або їх суміші.) тощо.
Нині зростає значення проведення тест-контролю при оцінці якості харчової
продукції та сировини, а також при оцінці забрудненості об'єктів навколишнього середовища безпосередньо у місцях пробовідбору.
Переважна більшість аналітичних реакцій відбувається у розчинах. Яким би чином неогранічна речовина, що аналізується, не переводилася б у рочинений стан, одержується розчин, який містить не елементи, а іони, у вигляді яких ці елементи можуть існувати у розчині. Однакові іони проявляють однакові властивості і дают одні й ті самі аналітичні реації незалежно від того, до складу яких сполук вони входять. Наприклад, якщо до розчину хлористоводневої кислоти або її солей додають розчин нітрату срібла, в усіх випадках одержують однаковий характерний осад хлориду срібла. Якщо записати ці реації в іонному вигляді, стає ясно, що в усіх випадках відбувається одна аналітична реакція:
Cl– + Ag + = AgCl
Тому аналітичні реакції вивчаються окремо для катіонів і аніонів.
Реактиви, за допомогою яких певний іон можна виявити у присутності
інших іонів, називають специфічними. Специфічних реактивів дуже мало, тому перед відкриттям того чи іншого іона необхідно відокремити його від інших іонів, які дають аналітичні реакції з тим же реактивом. Порядок відокремлення одних іонів від інших і послідовність їх відкриття складають систематичний хід аналізу.
У систематичному ході аналізу використовуються такі реактиви, які
дозволяють із складної суміші іонів перевести в осад певну групу іонів для подальшого аналізу. Такі реактиви називають груповими, а групи іонів, які вони відокремлюють, - аналітичними групами. Усі катіони відповідно до їх аналітичних властивностей поділяються на п‘ять груп.
Існує декілька методів систематичного аналізу катіонів у залежності від застосування групових реагентів:
сульфідний (сірководневий) метод, групові реагенти – сірководень та сульфід амонію;
кислотно-основний метод, групові реагенти – кислоти (НС1, H2SO4) і основи (NaOH, KOH, NH3H2O);
аміачно-фосфатний метод, груповий реагент – суміш (NH4)2HPO4+NH3
Таблиця 3.1
Сірководнева класифікація катіонів
№ групи |
Катіони |
Груповий реагент |
Характеристика групи |
І |
K+, Na+, NH4+, Mg2+ |
немає |
– |
ІІ |
Ca2+, Ba2+, Sr2+ |
(NH4)2CO3 + NH4OH + NH4Cl Карбонати не розчиняються у воді |
CaCO3, SrCO3, BaCO3 - білі |
ІІІ |
Fe2+, Fe3+, Mn2+, Zn2+, Co2+, Ni2+, Al3+, Cr3+ |
(NH4)2S, pH 9,25 (NH4OH + NH4Cl) Сульфіди не розчиняються у воді, аміаку, розчиняються у НС1 |
Al(OH)3 - білий Cr(OH)3 – сіро-фіолетовий Fe2S3, FeS, NiS, CoS – чорні; ZnS – білий MgS – тілесний |
IV |
а) Cu2+, Hg2+, Cd2+, Bi3+, (Pb2+); б) As(III, V), Sb (III, V), Sn (II, IV) |
H2S, pH 0,5 Сульфіди не розчиняються в НС1 |
СuS, HgS,Bi2S3 – чорнi; CdS, As2S3, SnS2 – жовті; Sb2S3, Sb2S5 – оранжово-червоні; SnS – бурий; As(V) відновлюється в процесі осадження, As2S3 виділяється тільки в 6 М НС1 |
V |
Ag+, Pb2+, Hg22+ |
2 M HCl |
AgCl, PbCl2, Hg2Cl2 - білі |
Таблиця 3.2.
Кислотно-основна класифікація катіонів
№ групи |
Катіони |
Груповий реагент |
Характеристика групи |
І |
K+, Na+, NH4+ |
Немає. Хлориди, сульфати, гідроксиди розчинні у воді. |
– |
ІІ |
Ag+, Pb2+, Hg22+ |
2 M HCl. Хлориди не розчиняються у воді та кислотах |
AgCl, PbCl2, Hg2Cl2
|
ІІІ |
Ca2+, Ba2+, Sr2+ |
1 М H2 SO4 Сульфати не розчиняютьсяу воді і кислотах |
Ca SO4, Sr SO4, Ba SO4 |
IV |
Zn2+, Al3+, Cr3+ As(III, V), Sn (II, IV) |
Надлишок 4 М NaOH або KOH. Гідроксиди не розчиняються у воді, розчиняються в кислотах і в лугах |
[Zn(OH)4]2–, [Al(OH)4]–, [Cr(OH)4]–, SnO22–, SnO32–, AsO33–, AsO43– |
V |
Mg2+, Mn2+, Bi3+, Fe2+, Fe3+, Sb (III, V) |
Надлишок 25% NH4OH/ Гідроксиди не розчиняються у воді, аміаку і лугах |
Mg(OH)2, Mn(OH)2, Bi(OH)3,Fe(OH)2, Fe(OH)3, Sb(OH)3, SbO(OH)3 |
VI |
Cu2+, Hg2+, Cd2+, Co2+, Ni2+ |
Надлишок 25% NH4OH. Гідроксиди не розчиняються у воді, надлишку лугу. Розчиняються в аміаку з утворенням аміакатів |
[Cu(NH3)4]2+,[Hg(NH3)4]2+, [Cd(NH3)4]2+,[Co(NH3)6]2+, [Ni(NH3)6]2+ |
3.1. Ідентифікація катіонів за сірководневою схемою
3.1.1. Характеристика реакцій катіонів першої та другої аналітичних груп:
K+, Na+, NH4+, Mg2+, Ca2+, Ba2+
З багатьох катіонів першої та другої аналітичних груп ми вивчаємо ті, що
безпосередньо пов‘язані з харчуванням людини. Тільки катіони барію отруйні і небезпечні для людини, але вони часто використовуються як важливий аналітичний реактив.
Катіони амонію утворюються при розчиненні харчових продуктів у концентрованій сірчаній (сульфатній) кислоті. Органічні сполуки при цьому руйнуються, а аміногрупи амінокислот, з яких побудовані білки, перетворюються на іони амонію. Визначивши кількість іонів амонію у розчині, що утворилися, визначають загальний вміст білків у харчовому продукті.
Натрій, калій, кальцій та магній у вигляді відповідних сполук споживаються людиною щодено у кількості від 0,5 до 5 г – це макроелементи. Натрію ми споживаємо більше ніж потрібно, звикнувши додавати NaCl під час приготування їжі. Тому дуже важливо врівноважувати це споживанням продуктів, багатих на калій, оскільки саме іони натрію і калію у певному співвідношенні підтримують осмотичну рівновагу в організмі людини і регулюють водний обмін. Кальцій потрібен дітям, у яких формуються кістки, і дорослим, оскільки він має протизапальні властивості і виконує багато інших функцій в організмі. Магній нормалізує діяльність нервової системи, знімає спазми, розширює судини та має інші важливі властивості.
Катіони першої та другої аналітичних груп утворюються елементами основних підгруп першої та другої груп періодичної системи. Усі однозарядні катіони належать до першої аналітичної групи разом з іонами амонію. Іони NH4+ у розчині за своїм зарядом і розмірами такі ж, як і іони К+. Оскільки осади солей утворюються за рахунок електростатичної взаємодії між катіоном і аніоном, іони NH4+ утворюють осади з усіма реактивами на іони К+ і заважають відкриттю калію.
Катіони Mg2+ залишаються у розчині разом з катіонами першої аналітичної групи, коли усі інші двозарядні катіони осаждуються карбонатом амонію – груповим реактивом другої аналітичної групи. Тому катіони магнію відносять саме до першої, а не до другої аналітичної групи.
3.1.1.1. Реакції катіонів і аналітичної групи
Катіони амонію – NH4+
1. Луги (NaOH, KOH, Ca(OH)2) утворюють з іонами амонію нестійкий гідроксид амонію, який розкладається (краще при нагріванні) з виділенням аміаку – безбарвного газу з характерним запахом:
NH4+ + OH- NH4OH H2O + NH3
Реакція відома (ще зі шкільного курсу) як найбільш специфічна, тому що усі інші неорганічні іони такого ефекту не дають і не заважають його спостерігати. Але для того щоб відчути ефект реакції, потрібна значна кількість іонів амонію. Більш чутливою, хоч менш специфічною є реакція Несслера.
2. Реактив Несслера містить дві речовини – KOH i K2HgJ4 - у водному розчині. З невеликою кількістью іонів амонію цей реактив утворює червоно–бурий осад оксодимеркурамоній – йодиду:
Hg
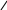
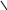
NH4+ + 4OH– + 2HgJ42– O NH2 J + 7J– + 3H2O
який розчиняється у надлишку NH4Cl, тому важливо, щоб цього надлишку не було.
Виконання: у чисту пробірку внести краплю розчину солі амонію
(NH4Cl, NH4NO3, або (NH4)2SO4), додати 5 - 10 крапель води, перемішати і вилити. До того розчину, який залишився на стінках пробірки, додати 4 - 5 крапель реактиву Несслера (не торкатися пипеткою стінок пробірки!). Спостерігати утворення у пробірці характерного осаду.
Реакція Несслера протікає у сильно–лужному середовищі (KOH входить до складу реактиву), тому усі катіони, що дають важкорозчинні гідроксиди, випадають в осад. З катіонів першої та другої аналітичних груп тільки катіони магнию дають з реактивом Несслера білий (або жовтуватий внаслідок забруднень) осад, який не заважає спостерігати утворення характерного червоно – бурого осаду, якщо у розчині є амоній. Інші катіони (3 – 5 аналітичних груп), що утворюють темно забарвлені осади гідроксидів, заважають реакції, особливо ферум (ІІІ), який дає з KOH червоно – бурий осад Fe(OH)3 .
Катіони калію – К+
1. Гексанітрокобальтат (ІІІ) натрію Na3Co(NO2)6 у нейтральному або слабокислому середовищі утворює з іонами калію жовтий кристалічний осад:
2K+ + Na+ + Co(NO2)63– K2NaCo(NO2)6
Виконання: у чисту пробірку внести 1 – 2 краплі розчину солі калію (KCl, KNO3 або K2SO4 ) і додати 2 – 3 краплі розчину Na3Co(NO2)6 (не торкатися піпеткою стінок пробірки!). Спостерігати утворення жовтого кристалічного осаду. Іноді осад утворюється поступово, протягом кількох хвилин.
Сильні кислоти і луги розкладають реактив. Для нейтралізації лужного середовища використовують слабку оцтову кислоту, надлишок якої не заважає цій аналітичній реакції.
Катіони амонію дають з реактивом такий самий осад, тому при виконанні задачі перед відкриттям іонів калію у невідомому розчині потрібно з окремою порцією цього розчину виконати реакцію Несслера, щоб упевнитися, що в ньому відсутні іони амонію.
Розчин Na3Co(NO2)6 має темно – коричневий колір з червонуватим відтінком. Реактив готують щодня, тому він зберігається у лабораторії окремо. Якщо розчин має рожевий колір, це означає, що реактив розклався. Такий реактив не дасть характерного осаду з невідомим розчином, навіть якщо там є іони калію. Тому треба приготувати свіжий розчин, або використати реактив №2.
2. Винна кислота або її кисла сіль гідротартрат натрію NaHC4H4O6 у слабокислому середовищі утворює з іонами калію білий кристалічний осад:
K+ + HC4H4O6– = KHC4H4O6 ↓
розчинний у сильних кислотах і лугах. У сильнокислому середовищі утворюються малодисоційовані молекули слабкої винної кислоти H2C4H4O6.
У лужному середовищі кисла сіль переходить у середню, а тартрат – іон C4H4O62– не осаджує іони калію. Слабкі кислоти (наприлад, оцтова) не розчиняють осад і не заважають виконанню реакції.
Гідротартрат калію може утворювати пересичені розчини. У такому випадку після додавання реактиву, якщо осад не утворився, треба занурити у розчин чисту скляну паличку і потерти нею стінки пробірки, на яких при цьому утворюються центри кристалізації.
Виконання: у чисту пробірку внести 3 – 4 краплі розчину солі калію і додати 4 – 5 крапель розчину NaHC4H4O6. Якщо осад не утворився, охолодити пробірку під краном з холодною водою, потерти скляною паличкою стінки пробірки.
Катіони амонію дають такий самий осад. Тому перед відкриттям іонів калію у невідомому розчині треба упевнитися, що там відсутні іони амонію. Якщо ж вони є , треба відокремити їх (солі амонію розкладаються при прожарюванні), а вже потім додавати реактив на іони калію.
Катіони нарію – Na+
Дигідроантимонат калію KH2SbO4 у водному розчині перетворюється у гексагідроксостибіат калію:
KH2SbO4 + 2H2O = KSb(OH)6 .
З іонами натрію цей реактив дає білий дрібнокристалічний осад:
Na+ + H2SbO4–– = NaH2SbO4
Для утворення осаду потрібна досить висока конценрація іонів натрію - реакція малочутлива. Продукт реакції - дигідроантимонат натрію - може утворювати пересичені розчини.
Виконання: у чисту пробірку внести 5 – 8 крапель розчину солі натрію
(NaCl, NaNO3 або Na2SO4) і додати 5 – 8 крапель розчину KH2SbO4 (не торкатися піпеткою стінок пробірки!). Якщо осад не випадає, треба занурити у розчин чисту скляну паличку і потерти нею стінки пробірки, тримаючи пробірку під краном з холодною водою.
У сильнолужному середовищі кисла сіль переходить у розчинну середню і осад не випадає. У кислому середовищі (навіть у слабкокислому, яке дають іони амонію) реактив розкладається і виділяється білий аморфний осад HSbO3, який заважає спостерігати реакцію на іони натрію. Тому реакція виконується у нейтральному або слабколужному середовищі (рН 7 - 8).
Іони магнію заважають реакції, тому що дають з реактивом білий дрібно-
кристалічний осад, як і іони нарію. Перед відкриттям іонів натрію у невідомому розчині потрібно упевнитися, що у ньому відсутні іони магнію, виконавши з окремою порцією цього розчину реакцію на Mg2+. Якщо ж іони Mg2+ є, їх треба відокремити у вигляді Mg(OH)2 за допомогою KOH.
Катіони магнію – Mg2+
1. Гідрофосфат натрію Na2HPO4 у слабколужному середовищі, яке
створюється амонійною буферною сумішшю (NH4Cl + NH4OH), утворює з іонами магнію білий кристалічний осад магній – амоній-фосфату:
Mg2+ + HPO42– + NH4OH MgNH4PO4 + H2O
розчинний у кислотах (навіть у слабких).
Виконання: у чисту пробірку взяти 1 – 2 краплі розчину солі магнію
(MgCl2, Mg(NO3)2 або MgSO4) додати 2 – 3 краплі NH4Cl, 1 – 2 краплі NH4OH, перемішати і додати 2 – 3 краплі Na2HPO4. Білий кристалічний осад повинен з‘явитися тільки після додавання останнього реактиву.
Гідрофосфат натрію утворює білі осади також з катіонами другої аналітичної групи:
3Ca2+ + 2HPO42– + 2NH4OH Ca3(PO4 )2 + 2NH4+ + 2H2O;
3Ba 2+ + 2HPO42– + 2NH4OH Ba3 (PO4 )2 + 2NH4+ + 2H2O.
тому перед відкриттям Mg2+ у невідомому розчині потрібно пересвідчитися, що там відсутні ці іони. Катіони другої аналітичної групи можна відкрити і відокремити від Mg2+ за допомогою групового реактиву (NH4)2CO3, який осаджує Ca2+ і Ba2+ але не осаджує Mg2+.
2. Гідроксид калію КОН осаджує іони Mg2+ у вигляді білого аморфного осаду Mg(ОН)2. Ця реакція використовується не для відкриття іонів Mg2+, а для їх відокремлення перед відкриттям іона Na+, якому Mg2+ заважає.
3. Карбонат натрію Na2CO3 осаджує іони Mg2+ у вигляді білого осаду основного карбонату магнію:
2Mg2+ + 2CO32– + H2O (MgOH)2CO3 + CO2
який розчиняється (не осаждується) у присутності солей амонію. З цією реакцією потрібно ознайомитися більш детально за підручником, щоб зрозуміти, чому Mg2+ потрапляє у першу, а не у другу аналітичну групу катіонів.
Реакції пп. 2 і 3 не використовуються для відкриття Mg2+, але вони дуже важливі для хіміко – аналітичної характеристики магнію, тому вивчення їх потрібно залишити як домашнє завдання для роботи з підручником.
