
- •Введение
- •Общие методические указания
- •Темы рефератов
- •Естественнонаучная и гуманитарная культуры Путь к единой культуре
- •Краткий очерк истории естествознания
- •Иерархия объектов в природе
- •Физические поля в природе
- •Фундаментальные взаимодействие в природе
- •Основные понятия и законы современного естествознания
- •Классическая механика.
- •Квантовая механика
- •Квантование. Принцип Паули.
- •Происхождение химических элементов
- •Релятивистская механика.
- •Статистическая механика
- •Системы с большим числом частиц
- •Динамические и статистические закономерности
- •Замкнутые многочастичные системы
- •Устойчивость систем
- •Нелинейные динамические системы
- •Биосфера
- •Механизмы и закономерности эволюции живой природы
- •Биомолекулы
- •Пространственная модель молекулы днк
- •Проблема жизни в естествознании
- •История эволюционных идей
- •Современные представления об эволюции
- •Направленность и ограниченность эволюционного процесса
- •Содержание
Биомолекулы
Эволюционные концепции систем неживой природы и живых организмов, сформулированные в середине 19-го века, имели противоположную направленность. Эволюция изолированных физических систем провозглашается вторым законом термодинамики – законом возрастания энтропии (Р. Клаузиус, 1850г.). Л. Больцман, установив связь между энтропией и вероятностью состояния системы, утвердил тем самым переход от порядка в системе к беспорядку, как стремление макроскопической системы к наиболее вероятному состоянию, что соответствует максимальному числу микросостояний.
Эволюционная теория в биологии, обнародованная Ч. Дарвиным в 1859 году, объясняет движущие силы эволюции в постепенном переходе живых форм от одних, простых, к другим более сложным и совершенным.
Попытки установить связь между физической и биологической эволюциями, теорией «создания структур» Ч. Дарвина и теорией «разрушения структур» Р. Клаузиуса, были безуспешными до недавнего времени. На рубеже 70-х – 80-х годов 20-го века в естествознание пришло понимание существенных различий природы равновесных и неравновесных процессов и создана теория открытых систем. Было строго доказано, что в открытых системах могут образовываться и долго существовать упорядоченные структуры. Спонтанно, неожиданно, непредсказуемо возникает «порядок из беспорядка».
В работах М. Эйгена и И. Пригожина впервые была сформулирована концепция отбора и эволюции биологических макромолекул из неупорядоченных систем на основе качественной теории гиперцикла, как одного из принципов структурной самоорганизации открытых систем. Пожалуй, впервые в истории науки вопросы зарождения жизни, отбора и эволюции были рассмотрены теоретически с чисто физических позиций.
Нам неизвестно в деталях как возникла жизнь на Земле. Можно только предполагать, что она образовалась в результате длительного процесса множества флуктуаций, происходящих в «первичном бульоне». Первичный бульон мог представлять собой водный раствор таких газов как метан СН , аммиак NH , углекислый газ СО , водород Н . В этом первичном бульоне зародились такие флуктуации, которые привели к первичной самоорганизации сначала на молекулярном уровне, к образованию молекул аминокислот, полисахаридов, липидов и других макромолекул.
Органические молекулы, такие как сахара, липиды, аминокислоты и нуклеотиды в открытой системе, при наличии источника энергии, могут синтезироваться в достаточно больших количествах. В 1924 году А.И. Опарин обратил внимание на то, что эти биологически важные молекулы могут самопроизвольно концентрироваться, образуя капли, названные коацерватами. Этот процесс вполне объясним с позиций физической химии. По ряду свойств коацерваты напоминают клетки простейших организмов. Благодаря самоорганизации в каплях, подобных клетке, создаются условия спонтанного образования биополимеров.
На следующем, более высоком, уровне организации макромолекулы клетки образуют надмолекулярные комплексы, например рибосомы, являющиеся комплексами нуклеиновых кислот и белков. Надмолекулярные комплексы, в свою очередь, образуют органеллы (ядро клетки, митохондрии и др.).
Аминокислоты. В первом приближении структуру молекулы аминокислоты можно представить в виде:
Н
|
NH![]() ―
С― СООН,
―
С― СООН,
|
R
Где NH - аминогруппа, СООН – карбоксильная группа, R – радикальная группа (радикал), в неё входит один или несколько атомов. Аминокислоты отличаются только радикалами. Аминокислоты в водной среде способны образовывать длинные цепи. В результате реакции поликонденсации аминогруппы и карбоксильной группы возникает первичная структура молекулы белка.
Н H H
| | |
NH ―С― СООН—NH —C—OOH―NH ―C―COOH―
| | |
R R R
Белки живых
организмов (от простейших одноклеточных
до высших млекопитающих) состоят из 20
типов аминокислот и определяют практически
все функции живой клетки. Каждый белок
состоит из нескольких, иногда десятков,
аминокислот. Последовательность, в
которую соединены различные аминокислоты,
индивидуальна для каждого типа белковой
молекулы. Очевидно, существует огромное
число способов (10![]() )
соединения 20 аминокислот в различные
последовательности. Каждый живой
организм обладает
собственными,
специфичными белками и поэтому проблема
трансплантации органов оказывается
столь трудной. Организм может отторгать
чужеродный орган, поскольку пересаженный
орган содержит белки, состоящий из тех
же аминокислот, но несколько в другой
последовательности. Белки, поглощаемые
с пищей, расщепляются в организме до
аминокислот, из которых в клетках
организма затем синтезируются белки
необходимые для данного организма. Так
происходит рост организма и замещение
старых, родительских клеток, дочерними
клетками.
)
соединения 20 аминокислот в различные
последовательности. Каждый живой
организм обладает
собственными,
специфичными белками и поэтому проблема
трансплантации органов оказывается
столь трудной. Организм может отторгать
чужеродный орган, поскольку пересаженный
орган содержит белки, состоящий из тех
же аминокислот, но несколько в другой
последовательности. Белки, поглощаемые
с пищей, расщепляются в организме до
аминокислот, из которых в клетках
организма затем синтезируются белки
необходимые для данного организма. Так
происходит рост организма и замещение
старых, родительских клеток, дочерними
клетками.
Рассматривая структурную организацию белков, надо указать её иерархичность. Имеются первичная, вторичная, третичная и, иногда, четвертичная структуры белка.
Первичная структура белка – это линейная последовательность аминокислот. Линейная цепь первичной структуры формируется при биосинтезе каждой молекулы белка на рибосоме клетки.
Вторичная структура
белковой молекулы – это
![]() - спирали, у которых каждая элементарная
единица включает несколько (до десятков)
элементов цепи первичной структуры.
- спирали, у которых каждая элементарная
единица включает несколько (до десятков)
элементов цепи первичной структуры.
Третичная структура – это способ расположения в пространстве первичной цепи как целого или способ размещения в пространстве элементов вторичной структуры. Например, хорошо изученная белковая молекула миоглобина, осуществляющая простые функции связывания и накопления кислорода в мышцах, особенно у водных млекопитающих (кашалотов) относится к - спиральным белкам. Первичная аминокислотная последовательность миоглобина состоит из 153 аминокислотных остатков. Вторичная структура представляет собой восемь - спиралей, которые вместе с боковыми группами сворачиваются в трехмерную структуру с приблизительными размерами 2*3*4 нм .
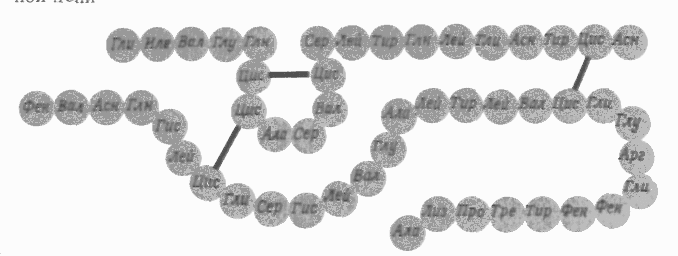
Первичная структура
– характеризует аминокислотный состав
и последовательность связи
![]() -аминокислотных
остатков в полипептидной цепи.
-аминокислотных
остатков в полипептидной цепи.
На рисунке показана первичная структура пептидных цепей инсулина (каждая аминокислота обозначена первыми тремя буквами её названия, например Гли – глицин, Ала – аланин, Вал – Валин и т.д.).
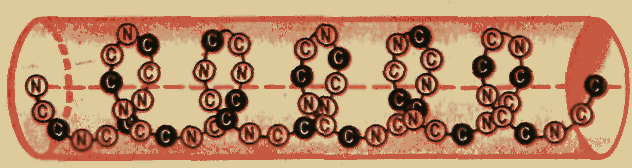
Вторичная структура полипептидной цепи молекулы белка в форме спирали (основной скелет без боковых цепей).
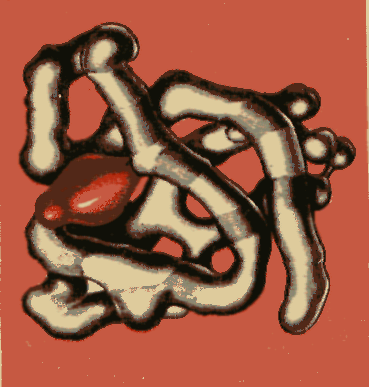
Третичная структура полипептидной цепи молекулы белка в форме изогнутого листа
Полипептидная цепь молекулы миоглобина, содержащая остатки 153 молекул различных аминокислот и небелковый остаток (выделен). Молекулы белков, наряду с молекулами нуклеиновых кислот ДНК и РНК, самые сложные из известных науке. Живые клетки построены из макромолекул белков, нуклеиновых кислот, полисахаридов и липидов. Строительными блоками нуклеиновых кислот являются нуклеотиды. В состав нуклеиновых кислот входят всего-навсего четыре типа нуклеотидов.
Остов молекул ДНК и РНК состоит из сахарно – фосфатных цепочек, к каждому сахару присоединены азотистые основания: А – аденин, Т – тимин, Г – гуанин и Ц – цитозин. Одноцепочечная молекула РНК вместо Тимина содержит У – урацил. Последовательность нуклеотидов в полимерной цепи молекулы ДНК может быть любой, но вторая сопряженная цепь должна строиться так, чтобы её нуклеотиды противостояли друг другу в соответствии с правилом:
Против А должно быть Т,
Против Т должно быть А,
Против Г должно быть Ц,
Против Ц должно быть Г.
При контакте плоских пар азотистых оснований энергетически выгодной оказалась укладка в стопку, а сахарно - фосфатные основания обвивают стопку двумя винтовыми линиями, причем плоскости азотистых оснований перпендикулярны оси двойной спирали молекулы ДНК. Эта модель непринужденно объясняет факт деления исходной клетки на две, в ядрах которых существовали бы идентичные молекулы ДНК. В самом деле, если развести обе ветви ДНК, то каждая из них будет достроена новой ветвью в соответствии с приведенным правилом.
